Massaspektrometria

Massaspektrometri (MS) eli massaspektrografi on laite, jota käytetään positiivisten tai negatiivisten ionien ominaisvarauksien ja molekyylien massojen tutkimisessa sekä fysikaalisessa tutkimuksessa. Suppeasti sanottuna massaspektrometrit ovat molekyylivaakoja, vaikka niitä ei suoraan käytetä molekyylien massojen selvittämiseen.[1]
Massaspektrometrit koostuvat pääpiirteittäin ionilähteestä, massa-analysaattorista ja ionien havaitsimesta. Ionisaattorilla kiinteästä, nestemäisestä tai kaasumaisesta aineesta tuotetaan kaasuuntuneita ioneita. Ioneita voidaan erotella monin eri tavoin: muun muassa niiden liikemäärien tai nopeuserojen avulla. Kaikki massaspektrometrit kuitenkin erottelevat ionit niiden massa-varaus -suhteen, eli m/z (kirjoitetaan kursivoituna) mukaan, eivätkä ionien massan perusteella, toisin kuin ”massaspektrometri”-termi antaa ymmärtää. Erotellut ionit havaitaan eri menetelmin ja niistä tehdään kuvaaja, massaspektri. Yleisen käytännön mukaan x-akselille asetetaan havaittujen ionien m/z-arvot ja y-akselille ionien suhteelliset osuudet yleensä prosentteina.[1]
Yksiköttömistä m/z-arvoista voidaan laskea havaittujen ionisoituneiden atomien tai molekyylien massat kertomalla ionien m/z-arvot ionien varauksilla mikäli varaukset tunnetaan. Isotooppien luonnollinen jakauma, protonaatiot (vety-ionien liittymiset/poistumiset) tai muut kemialliset muutokset tulee kuitenkin ottaa huomioon kun tutkitun aineen ionisoimattoman ja kemiallisesti muuntumattoman muodon massa halutaan selvittää. Massat ilmaistaan tavallisesti yhtenäistettyinä atomimassayksikköinä (u) tai daltoneina (Da) yleensä käyttäen kokonaisluvuiksi pyöristettyjä nominaalisia tai desimaalisia monoisotooppisia massoja. u ja Da ovat yksiköinä yhtä suuret (1 u = 1 Da), joten kumpaa vain voidaan haluttaessa käyttää.[1]
Yksiköiden Da ja u lisäksi thomsoneita (Th) on käytetty massan yksikköinä. IUPAC ei ole 2013 jälkeen suositellut thomsonien käyttöä. Th on ionin massa Da tai u yksiköissä jaettuna ionin negatiivisella/positiivisella varauksella. Thomson voi siten olla positiivinen tai negatiivinen yksikkö, toisin kuin u tai Da.[2]
Kaikki massaspektrometrit toimivat ainakin osin tyhjiötä lähellä olevassa hyvin matalassa paineessa eli vakuumissa. Tämä mahdollistaa ionien liikkeen laitteistossa, sillä muuten ionit törmäisivät ilman molekyyleihin ja atomeihin menettäen varauksensa, jolloin niitä ei voida havaita. Fragmentoinniksi kutsuttua tahallista molekyylien hajotusta esimerkiksi jalokaasujen avulla saatetaan kuitenkin joissain tilanteissa käyttää. Lisäksi tietynlaisissa API-ionisaattoreita (engl. atmospheric pressure ionization) käyttävissä massaspektrometreissä ionisaatio tapahtuu ilmakehän paineessa, mutta muut vaiheet etenevät vakuumissa.[1] Näistä kerrotaan alla kohdissa APCI ja APPI.
Historia
Ensimmäisen massaspektrometrin rakensi J. J. Thomsonin oppilas Francis Aston vuonna 1919. Massaspektrometrin avulla Aston pystyi erottelemaan toisistaan lukuisien aineiden isotoopit.[1]
Massojen määritelmät
Massaspektrometriassa voidaan käyttää useita ionisoituneiden atomien ja molekyylien massan eri määritelmiä. Alla olevien esimerkkien arvot ovat pyöristettyjä arvoja kirjoitushetken (2017) tarkimmista tunnetuista isotooppien massoista. Kaikkien muiden massojen, paitsi nominaalisen massan laskemisessa ja tarkan massan määritelmässä, käytetään kemiallisesti sitoutumattomien yksittäisten perustilan (virittymättömien) isotooppien lepomassoja (isotoopit ovat paikallaan).

Nominaalinen (engl. nominal) massa lasketaan jokaisen maankuoren yleisimmän isotoopin kokonaisluvuiksi pyöristetyistä massoista.[3] Esimerkiksi 1H = 1 u ja 16O = 16 u, joten 1H216O = 18 u.[4]
Monoisotooppinen (engl. monoisotopic) massa lasketaan jokaisen maankuoren yleisimmän isotoopin desimaalisista massoista.[3] Esimerkiksi 1H = 1.00783 u ja 16O = 15.99491 u, joten 1H216O = 18.01057 u.[4]
Keskimääräinen (engl. average) massa lasketaan desimaalisilla standardiatomipainoilla.[3] Esimerkiksi H = 1.00784 u ja O = 15.99903 u, joten H2O = 18.01471 u.[4] Standardiatomipainot (engl. standard atomic weight) ovat alkuaineen isotooppien massojen keskiarvoja, jotka on laskettu ottaen huomioon isotooppien suhteellinen yleisyys maankuoressa.[3] Nämä arvot löytyvät pyöristettyinä useimmista jaksollisen järjestelmän taulukoista.
Kaikkein yleisin (engl. most abundant) massa on yleisimmän havaitun ionisoituneen isotoopin tai isotooppiyhdistelmän massa. Ionia kutsutaan pääasialliseksi ioniksi (engl. principal ion). Harvinaisempien isotooppien tilastollinen todennäköisyys olla osana molekyyliä kasvaa molekyylin kasvaessa. Siksi massaspektrissä suurin tietyn molekyylin aiheuttama havaittu piikki poikkeaa monoisotooppisesta massasta, jos molekyyli on kyllin suuri. Suurissa molekyyleissä monoisotooppinen massa voi olla spektrissä näkymätön.[3] Tämä näkyy kuvassa.
Tarkka (engl. accurate) massa on kokeellisesti mitattu massa.[3]
Eksakti (engl. exact) massa on valittujen isotooppien massoista laskettu teoreettinen massa. Jos molekyylissä on muita kuin yleisimpiä isotooppeja (esimerkiksi 1H sijaan 2H) kutsutaan eksaktia massaa myös isotopologiseksi (engl. isotopologue) massaksi monoisotooppisen massan sijaan.[3]
Massavajeeksi (engl. mass defect) kutsutaan eroa monoisotooppisen ja nominaalisen massan välillä.[3]
Resoluutio

Resoluutiolla (R) eli erotuskyvyllä tarkoitetaan massaspektrometrin kykyä erottaa toisistaan eri m/z omaavien ionien signaalit toisistaan. R määritellään usein seuraavasti:[1]
R = m / Δm = m1 / (m1 – m2)
Oikealla kuvassa olevan piikin resoluutio lasketaan piikin leveydestä korkeudelta, jossa h:n arvo on puolet H:n arvosta, eli puolivälinarvon leveydellä (engl. full width at half-maximum, FWHM). Vasemmalla kuvassa näkyvän h:n korkeus saa yleensä olla enimmillään 10% H:n korkeudesta ICR-analysaattoreilla ja muilla korkean resoluution laitteilla. Arvon maksimi on tyypillisesti 50% kvadrupoleilla, TOF-analysaattoreilla ja vastaavilla matalan resoluution laitteilla. Suurempi resoluution arvo merkitsee parempaa resoluutiota. Resoluutioon vaikuttaa käytetty analysaattori.[1]
Massatarkkuus
Massatarkkuudella (engl. mass measurement accuracy, MMA) puolestaan tarkoitetaan eroa kokeellisesti mitatun ja teoreettisesti lasketun massan välillä. MMA lasketaan seuraavasti:[1]
MMA = mkokeellinen – mteoreettinen
Arvo ilmaistaan usein miljoonasosina (ppm), joten:
MMA = (mkokeellinen – mteoreettinen) / mteoreettinen x 106 ppm
Pienempi arvo on parempi. Mittauksia samasta näytteestä toistetaan lähes aina ja näistä lasketaan spektriin esitetty keskiarvo. Massoiksi ilmoitettuihin arvoihin liitetään yleensä toistettujen mittausten keskihajonta, eli standardipoikkema (esim. 2000 ± 10 u).[1]
MMA voi kuitenkin ”siirtyä” erityisesti analysaattorin epävakauden vuoksi, jolloin usean mittauksen tekeminen ei auta. Siirtymää tapahtuu erityisesti korkean resoluution analysaattoreissa, kuten FT-ICR-laitteissa. Jos kyse on vain epävakaudesta, voidaan MMA:n arvoa pienentää laitteen kalibraation avulla. Korkean resoluution laitteet saattavat vaatia päivittäisen kalibraation.[1]
Ionisaattorit
Ionisaattorissa tapahtuvassa ionisaatiossa näytteeseen tuodaan eri tavoin energiaa, jotta se saadaan kaasuuntumaan ja/tai ionisoitumaan. Siksi tutkittavat aineet voivat ionisaatiossa pilkkoutua pienemmiksi osasiksi, eli fragmentoitua. Tutkittavasta aineesta riippuen tähän voidaan pyrkiä tai tätä vältetään. Tarkoituksenmukainen fragmentaatio kuitenkin yleensä tapahtuu erillisessä vaiheessa erilaisin menetelmin. Ionisaatiomenetelmä valitaan tutkittavan näytteen mukaan. Ionisaattoreihin, jotka toimivat jatkuvalla näytesyötöllä, voidaan usein yhdistää erilaisia puhdistimia tai erottimia helpottamaan ja automatisoimaan analyysiä. Joihinkin voidaan esim. liittää kromatografi, joka erottaa näytteen eri osiin (fraktioihin) näytteessä olevien molekyylien kemiallisten ominaisuuksien avulla.[1]
Tähän kappaleeseen ei ole lueteltu kaikkia olemassa olevia ionisaattoreita.
Elektroni-ionisaatio (EI)
Elektroni-ionisaatiossa (EI) tyypillisesti kaasumainen näyte ionisoidaan sähköllä kuumennetun hehkulangan (filamentin) avulla. Langasta irtoaa elektroneja kaasuun ja kaasun osaset ionisoituvat. Menetelmä johtaa usein ionien fragmentaatioon.[1]
Kemiallinen ionisaatio (CI)
Kemiallisessa ionisaatiossa (engl. chemical ionization, CI) tuotetaan kemiallisin menetelmin ioneita kaasusta. Tämä voi tapahtua esimerkiksi protonien (H+) siirron kautta käyttämällä ionisoitunutta kaasua GH+, jotka voivat siirtää protoninsa tutkittavalle kaasumaiselle aineelle M, jolloin saadaan MH+, kaasuntuneita näytteen ioneita. Kemiallisessa ionisaatiossa voidaan käyttää myös muita ionisoituneita kaasuja. Elektroni-ionisaatioon verrattuna kemiallinen aiheuttaa vähemmän fragmentaatiota.[1]
Kenttäionisaatio (FI)
Kenttäionisaatiossa (engl. field ionization, FI) ioneita tuotetaan kaasusta vahvan sähkökentän avulla. Menetelmässä suuren jännitteen omaava positiivisesti varautunut elektrodi sieppaa kaasun molekyyleiltä tai atomilta elektronin tai elektroneja, jolloin kaasu ionisoituu saaden positiivisen varauksen. Kenttäionisaatiossa voi muodostua MH+-ionien lisäksi M•+-radikaaleja. Menetelmä saa aikaan fragmentaatiota hyvin vähän, mutta sen heikon ionisaatiotehon vuoksi sitä käytetään lähinnä kun EI- tai CI-menetelmät eivät ionisoi tutkittavaa näytettä molekyyli-ioneiksi.[1]
SIMS
Sekundääristä ionimassaspektrometriaa (SIMS) käytetään ionisoimaan lähinnä kiinteitä aineita. Siinä primääriseksi kutsuttu kohdistettu ionisuihku ionisoi näytteen tuottaen sekundäärisiksi kutsuttuja ioneita. Matalan jännitteen ionisuihkuja käyttäviä SIMS-ionisaattoreita kutsutaan staattisiksi, sillä ne eivät vaurioita näytettä. Dynaamisissa SIMS:eissä suihkut ovat voimakkaampia ja aiheuttavat näytteen eroosiota. SIMS:ejä käytetään erityisesti johtavien pintojen tutkimiseen. Nopeaa atomipommitusta (engl. fast atom bombardment, FAB) ja LSIMS:iä (engl. liquid SIMS) käytetään haihtumattomaan liuottimeen liuotetun näytteen tutkimiseen ionisuihkun avulla.[1]
Kenttädesorptio (FD)
Kenttädesorptiossa (FD) ionisoidaan näytteitä samaan tapaan kuin kenttäionisaatiossa, mutta menetelmän kanssa käytetyt näytteet ovat haihtumattomia (ja siten eivät kaasuja). FD:ssä näyte liuotetaan nesteliuottimeen ja liuotin haihdutetaan pois säiliössä, jossa on runsaasti filamenttejä. Liuottimen haihtuessa näyte jää filamenttien pinnoille. Filamentteja kuumennetaan sähkövirralla, näyte sulaa ja ionisoituu. Ionit siirtyvät filamenttien kärkiin, joista ionit desorptoituvat (kaasuuntuvat). Fragmentaatiota ei tapahdu FD:ssä juuri lainkaan. Osaavan käyttäjän vaativa FD on harvoin käytetty ja haastava tekniikka. FD toimii hyvin muun muassa ei-polaaristen yhdisteiden kuten polymeerien ionisoinnissa.[1]
Plasmadesorptio (PD)
Plasmadesorptiossa (PD) näyte asetetaan aluminoidulle nailonkalvolle, jossa se altistetaan kaliforniumin isotoopin 252 fissiotuotteille, jotka johtavat näytteen ionisoitumiseen. Matriisiavusteinen laserdesorptio (MALDI) on korvannut menetelmän lähes kokonaan.[1]
Laserdesorptio ja MALDI
Laserdesorptiossa (LD) näyte ionisoidaan levyltä UV tai IR laserin hyvin lyhyen ja intensiivisen pulssin avulla vakuumissa. Näyte kaasuuntuu ja ionisoituu. LD:n hyvin yleisesti käytetty muunnelma on matriisiavusteinen laserdesorptio (engl. matrix-assisted laser desorption, MALDI). MALDI toimii suurille, jopa 300 000 Da molekyyleille. Menetelmä soveltuu haihtumattomille, suurille ja poolisille (vesiliukoisille) yhdisteille, ja sitä käytetään erityisesti monille biomolekyyleille, kuten proteiineille, hiilihydraateille ja lipideille. Fragmentaatiota (näytemolekyylin hajoamista) tapahtuu vähän ja MALDI:ssa on korkea toleranssi näytteen epäpuhtauksille muihin yleisiin menetelmiin kuten ESI:in verrattuna.[1]

MALDI:ssa on yleensä tasainen metallilevy, jossa on rajattuja alueita näytteille. MALDI:n ero pelkkään LD:hen on se, että MALDI:ssa näyte on runsaan matriisin seassa, joka absorboi laserin energian, jolloin näyte ei fragmentoidu merkittävästi. Tavallisessa LD:ssä ilman matriisia tutkittava aine fragmentoituu, erityisesti jos se on suuri ja herkkä molekyyli, kuten jokin proteiini. Matriisi koostuu tietynlaisista näytteestä tyypillisesti tutkittuihin molekyyleihin verrattuna pienistä orgaanisista molekyyleistä, jotka ovat matriisiin ominaisuuksiltaan sopivia, absorboiden muun muassa tehokkaasti laserin säteilyä.[1]
Matriisi on MALDI:ssa kiinteä ja se valmistetaan liuoksesta, jossa on näytteen molekyyleihin verrattuna moninkertaisesti matriisimolekyylejä. Liuoksesta asetetaan pisara levylle, pisaran annetaan kuivua ja matriisin kiteytyä.[1]
Näyte desorptoidaan kaasuksi tyhjiötä lähellä olevassa paineessa (vakuumissa) lähettämällä siihen lyhyt laserpulssi. Kiinteästä matriisista irtoaa matriisia ja näytettä. Näyte todennäköisesti ionisoituu matriisin siirtäessä protoneita näytemolekyylille.[1]
Huonosti protonoituvista aineista voidaan tuottaa positiivisia ioneita (kationeja) lisäämällä matriisiin valmistusvaiheessa vähän emästä, kupari- tai hopeakationeja. Ionisointi voidaan usein toistaa MALDI:ssa samasta kohtaa levyltä näytteen ja matriisin seosta, mutta saadut signaalit poikkeavat toisistaan hyvin tarkkaan analyysiin, sillä edeltävä laserpulssi rapauttaa seosta muuttaen sen absorbtio-ominaisuuksia.[1]
Menetelmä soveltuu hyvin TOF-analysaattoreihin (MALDI-TOF), sillä se tuottaa ioneita pulsseina[1]
MALDI:n muunnelmia ovat muun muassa SALDI (engl. surface-activated laser desorption ionization), AP-MALDI (engl. atmospheric pressure) ja DIOS (engl. desorption ionization on silicon), jossa matriisina on kiinteää huokoista silikonia. DIOS:ssa on useita etuja MALDI:iin nähden: sillä kyetään havaitsemaan pienempiä molekyylejä, näytteen valmistus analyysiin on yksinkertaisempaa ja se on MALDI:akin tolerantimpi epäpuhtauksille. Menetelmää käytetään yleensä 100–3 000 daltonin molekyylien tutkimiseen. DIOS on täydentävä tekniikka MALDI:lle, eikä sen korvaaja. AP-MALDI:ssa näytelevy on ilmakehän paineessa, jolloin näytelevyn vaihtaminen on nopeaa, sillä sitä ei tarvitse asettaa vakuumiin esimerkiksi luukkujen kautta.[1]
Thermospray
TSP:ssä (engl. thermospray) suoloja sisältävä näyte pumpataan kuumennettuun ohueen putkeen (kapillaariin). Näyte kuumenee kapillaarissa ja päätyy sen kautta pieneen vakuumikammioon yliäänennopeudella liikkuvana hienojakoisena suihkuna. Kammion kyljessä on reikä, jonka ulkopuolella on sarja sähköisesti varattuja levyjä, joissa on reikä keskellä. Vastapuolella kammion reikää on positiivisia tai negatiivisia ioneita luotaan työntävä elektrodi. Ionit työntyvät sen vaikutuksesta ohivirtaavasta suihkusta reiästä ulos ensimmäisen levyn (linssin) reiälle. Levyt kohdistavat vastaanottamansa ionit tiiviiksi suihkuksi, jonka ne kiihdyttävät jatkuvana syöttönä eteenpäin esimerkiksi kvadrupolierottimelle.[1]
ESI

ESI tai ES (engl. electrospray ionization) on MALDI:n ohella hyvin yleinen ionisaatiomenetelmä, missä näyte sumutetaan ioneiksi jatkuvalla syötöllä sähkövirran avulla. Syntyvät ionit ovat monivarauksellisia, toisin kuin pulssimaisessa MALDI:ssa. ESI:ssä on matalampi toleranssi epäpuhtauksille kuin MALDI:ssa tai sen muunnelmissa.[1]
ESI:n putkimainen suutin on varattu kyllin suurella jännitteellä, jotta siihen saadaan osittain nesteen pintajännityksen vaikutuksesta muodostamaan Taylorin kartio (cone). Jännitteen olleessa suurempi kuin nesteen pintajännitys saadaan suutin ryöpyttämään sopivan pieniä ioneita sisältäviä pisaroita. Ilman jännitettä pisaroita ei muodostu. Toinen elektrodi on vastapäätä putkisuutinta. ESI on siten sähkökemiallinen piiri, jossa virtaa välittävät positiiviset tai negatiiviset ionit. Tämän vuoksi ESI:n havaitsemisherkkyys ei ole riippuvainen siihen syötetyn näytteen tilavuudesta, vaan pelkästään näytteen ionien pitoisuudesta. Ionien pitoisuuden tulee olla sopiva ja tätä voidaan lisätä elektrolyyttien avulla. Liian suurta pitoisuutta tulee kuitenkin välttää ja usein käytännössä näytteestä joudutaan poistamaan elektrolyyttejä esimerkiksi kromatografian avulla ennen ESI:ä.[1]

Ioneita sisältävät liuotinpisarat etenevät elektrodia kohti yleensä liuottimesta erillisen kaasuvirran (engl. nebulizer gas) avustamana. ESI:ssä suihkua vastaan tuleva kuuma kuivauskaasu haihduttaa niistä liuotinta. Kukin pisara räjähtää (fissioituu) kun se ylittää Rayleighin rajan, eli kun pisaran sisäinen varaus ylittää pisaran pintajännityksen energian. Sisäinen varaus johtuu ioneista ja kunkin pisaran varaus kasvaa liuottimen haihtuessa, kun ionien pitoisuus pisaroissa kasvaa. Pisarat räjähtävät pienemmiksi pisaroiksi vapauttaen samalla ioneita. Pisarat jatkavat toistuvaa räjähtämistään suihkun edetessä, kunnes pisarat ovat olemattoman pieniä. Jotkin ionit neutraloituvat reiällisellä elektrodilla, mutta osa jatkaa suihkuna matkaa sen reiän kautta massa-analysaattorille.[1]
Ionien fissioitumiselle on kolme mallia: IEM (ion evaporation model), CRM (charge residue model) ja uusin CEM (chain-ejection model). Pienille ioneille pätevässä IEM:ssä ioneita poistuu (desorptoituu) suoraan pisaran pinnalta.[5] Suurille ioneille, kuten proteiineille pätevässä CRM-mallissa ionit eivät poistu pisarasta, vaan liuotinta haihtuu pois pisarasta, kunnes saavutetaan pelkkiä kaasufaasin ioneita.[6] Vuonna 2013 ehdotetussa CEM-mallissa suuret laskostumattomat polymeerit voivat osittain poistua pisaran pinnalta ja lopulta kokonaan.[7]

ESI tuottaa monivarauksellisia ioneita. Varausten määrä on yleensä suhteellinen näytemolekyylien pinta-alaan ja mitä suurempia molekyylit ovat, sitä suurempi on niiden varaus. Monivaraukset mahdollistavat suurten ionien tutkimisen massa-analysaattoreilla, joilla on pieni nominaalisen massan raja (eivät kykene erottamaan kovin suuren m/z omaavia ioneita). m/z laskee varauksen kasvaessa, sillä z on ionin varaus. Varaus kuitenkin tulee tuntea, ja tämä hieman hankaloittaa ESI:n käyttöä, mutta ionien massojen selvittämiseen käytetään kehittyneitä tietokonealgoritmeja. Saatu spektri usein dekonvoloidaan, jossa muutetaan m/z-arvot massoiksi matemaattisesti spektrin tulkinnan helpottamiseksi. Dekonvolaatiossa tieto varaustilojen jakaumasta (CSD) hävitetään ja saadaan tilalle spektri, jossa näkyvät vain nollavaraukset ja siten x-akselille saadaan massa m/z sijaan.[1]
Yksi ESI:n muunnelmista on DESI (engl. desorption electrospray ionization).[1]
APCI
APCI (engl. atmospheric pressure chemical ionization) on CI:n kaltainen menetelmä, jossa ionisaatio tapahtuu ilmakehän paineessa. Näyte on poolinen (vesiliukoinen) tai verrattain heikosti poolinen. APCI:ssa syötetään paineen avulla nestemäistä enimmillään 1 500 daltonin molekyylejä sisältävää näytettä ohueksi sumumaiseksi suihkeeksi virtauskaasun avustamana lämmittimen ohi. Lämmitin kuumentaa suihkun, jolloin suihkun pisaroista haihtuu liuotin ja jäljelle jäävät näytemolekyylit, jotka liikkuvat koronapurkauksia tuottavan elektrodin ohitse. Elektrodilla tapahtuu virtauskaasun ja näytemolekyylien välillä kemiallinen ionisaatio, minkä jälkeen näyteionit jatkavat matkaansa massa-analysaattorille.[1]
APPI
APPI (engl. atmospheric pressure photoionization) toimii kuten APCI, mutta siinä ionisaation saa aikaan UV-lampun lähettämien fotonien aiheuttama fotoionisaatio koronapurkausten sijaan. APPI:a käytetään kun APCI:n tai ESI:n avulla ei voida ionisoida tutkittuja aineita.[1]
DART
DART:issa (engl. direct analysis in real time) tutkitaan kiinteitä pintoja nesteissä ja kaasuissa ilman näytteen valmistelua. Fragmentaatiota ei juurikaan tapahdu. Pinta ei muunnu, sillä ionisaatio tapahtuu ilmakehän paineessa ja ilman sähköisiä jännitteitä. Kaasua kuten heliumia tai typpeä ionisoidaan, sitten neutraloidaan verkkomaisen elektrodin avulla ja tämä neutraaleja osasia sisältävä suihku ohjataan tutkittavalle pinnalle. Neutraalit osaset ionisoivat näytettä ja ilman. Ionit syötetään massa-analysaattorille.[1]
Massa-analysaattorit
Massa-analysaattorilla tutkitaan ja usein erotetaan ionisaattorin tuottamat ionit. Analysaattoreita on monenlaisia. Ne luokitellaan ionien liike-energian eroihin perustuviin sähköstaattisiin sektorianalysaattoreihin (engl. electric sector, E tai ESA), liikemäärien eroihin perustuviin magneettisektorianalysaattoreihin (engl. magnetic sector, B), lentoradan vakauden eroihin perustuviin kvadrupolianalysaattoreihin (engl. quadrupole, Q), liikenopeuden eroihin perustuviin TOF-analysaattoreihin (engl. time-of-flight), ioniloukku- (engl. ion trap, IT), FTICR- (engl. fourier transform ion cyclotron resonance) sekä FT-OT-laitteisiin (engl. fourier transform orbitrap), joista kolmessa jälkimmäiseksi mainitussa ionien erottelu ja analyysi perustuu ionien resonanssitaajuuksien eroihin.[1]
Tähän kappaleeseen ei ole lueteltu kaikkia olemassa olevia analysaattoreita.
Tandemi- ja hybridianalysaattorit
Analysaattoreita voidaan yhdistää eri menetelmiä käyttäviksi ketjuiksi. Tätä kutsutaan tandemimassaspektrometriaksi (MS/MS tai MS2) ja yhdistetyistä analysaattoreista koostuvaa laitetta hybridimassaspektrometriksi. Näissä yhdistetään vähintään kaksi samanlaista tai erilaista analysaattoria. Hybridimassaspektrometrejä käytetään useisiin tarkoituksiin: rakenteen, isotooppien, fragmentoitumismekanismien, termokemialliseen ja korkeaa herkkyyttä vaativaan tutkimiseen.[1]
Hybridimassaspektrometriat jaetaan tila- ja aikahybridimassaspektrometrioihin. Tilahybridi-MS:sissä ionit erotellaan fyysisesti toisistaan. Tähän luokkaan kuuluvat muun muassa kvadrupoli-, TOF-sähköstaattiset- ja magneettiset analysaattorit. Näitä voidaan käytännössä liittää 3–4 analysaattorin ketjuiksi. Aikahybridi MS:sissä ionit vangitaan samaan tilaan ja ne erotellaan analysaattorissa tietyn ajanjakson aikana. Näihin kuuluvat FTICR-, orbitrap- ja muunlaiset ioniloukkuanalysaattorit. Näitä voidaan käytännössä liittää 7–8 analysaattorin ketjuiksi, sillä ioneita ei välttämättä hävitetä ioniloukuissa, jolloin ketjun viimeisellekin analysaattorille voidaan vielä syöttää ioneita.[1]
Kvadrupoli ja multipolit

Vuonna 1953 keksityissä kvadrupoleissa (quadrupole, Q) erottelu perustuu ionien lentoratojen vakauksien eroihin. Siinä ioneita suihkutetaan ionisaattorilta sähköisesti varattujen reiällisten levyjen (linssien) kautta, jotka saavat suihkun liikkeelle eteenpäin.[1] Ionien m/z erottelu tapahtuu neljän keskenään lineaariseen pyöreään tankoon johdetun tasavirran (DC) ja niiden sähkökentän muutostaajuuden avulla ja ionit ohjautuvat tankojen välistä havaitsimelle. Sähkökenttää voimistetaan avulla vuorotellen per tanko, josta saadaan kentän muutostaajuus. Ionit kiertävät tankojen välistä spiraalimaista rataa. Muuttamalla tankojen jännitteitä voidaan valita analysaattoriin vain tietyn m/z omaavia ioneita ja siten muuntamalla DC/muutostaajuuden suhdetta ioneista saadaan tietyltä m/z alueelta MS spektri.[1]
Laitteen tasavirta asettaa m/z ylärajan ioneille ja suodattaa pois liian suuren m/z ionit. Laitteen tasavirran aikaansaamien sähkökenttien muutoksen taajuus suodattaa pois liian matalan m/z ionit. Laitteen DC/muutostaajuuden suhde muodostaa pienen alueen, joka päästää läpi vain tietyn m/z ionit, muut osuvat tankoihin tai lentävät ulos niiden välistä.[1]
Muunnelmia kvadrupoleista ovat muun muassa heksapolit (näissä kuusi tankoa, H/h), oktapolit (näissä kahdeksan tankoa, O/o), sekä muut multipolit. Näitä sisältävien tandemimassaspektrometrien nimien lyhenteissä tavallisesti isokirjaiminen Q/H/O symboloi analyyttistä MS:sää, joka tuottaa spektrin ja q/h/o symboloi MS:sää, joka ei tuota spektriä (engl. RF-only MS), mutta sitä käytetään usein tarkoituksenmukaiseen ja eri menetelmin tapahtuvaan ionien hajottamiseen (fragmentointiin) hybridi MS:issä.[1]
Orbitrap

Orbitrap (”kiertoloukku”) on vuonna 2005 toteutettu massan analysointilaite. Ionien erottelu ja analyysi perustuu niiden resonanssitaajuuksien eroihin. Orbitrapien resoluutio on korkea ja riippuu ionien m/z-arvoista. Resoluutio heikkenee m/z-suhteen kasvaessa.[1]
Laitteessa on tynnyrimäinen ontto elektrodi, jonka sisällä on kiinteä elektrodi, joka sieppaa ionit kiertävään liikkeeseen itsensä ympärille. Ionien kiertävä liike aiheuttaa sähkövirran muutoksia ulkoiselle elektrodille. Muutoksien yhdistyneet taajuudet muutetaan Fourierin muunnoksen avulla m/z-arvoiksi massapektriin.[1]
Ionit jäävät loukkuun kiertämään elliptisiä ratoja pitkin, koska niiden sähköinen vetovoima sisäiseen elektrodiin kumoutuu niiden kiertoliikkeen inertian (jatkuvuuden) vuoksi. Ionien radat kiertävät edestakaisin elektrodia tietyllä alueella, jolloin niiden radat muistuttavat spiraalia. Edestakaiset liikkeet ovat riippumattomia ionien liikkeestä elektrodin ympäri ja kaikista muista parametreistä, paitsi ionien m/z-arvoista.[1]
Elektrodien välistä jännitettä madalletaan aluksi, jotta ionit voidaan suihkuttaa kammioon. Ionien päätyessä kammioon aletaan jännitettä nostaa kunnes ionit saavuttavat halutun kiertoradan, jonka jälkeen jännitteet pidetään vakioina.[1]
Orbitrapeissa ionisaation lähteenä käytetään muun muassa MALDI-laitteita, sillä ne tuottavat lyhyen sopivan pulssimaisen ionipaketin, mutta ESI-laitteita ei voida käyttää sellaisenaan, sillä niissä ionisuihku on jatkuvaa.[1]
Kaikissa kaupallisissa orbitrapeissa tynnyrimäiseen kammioon saapuvat ionit jaotellaan C-loukun (trap) avulla. C-loukku koostuu yleensä suunnilleen C:n muotoon taivutetuista useista elektrodeista, joiden keskellä on tila, jota pitkin ionit pääsevät liikkumaan. Ionien saapuessa loukkuun, loukun päällimmäisiin ja alimmaisiin elektrodeihin asetetaan muuttuvat vaihtovirran aiheuttamat sähkökentät, jotka ajavat ioneita keskelle C-loukun rataa. Ionit jäävät liikkumaan tietylle alueelle loukkuun. Törmäykset loukussa olevan typen kanssa hidastavat ioneita. Kyllin suuren hidastumisen jälkeen (kun ioneilla on sopiva kineettinen energia) erisuuruiset tasavirrat asetetaan C-loukun elektrodeihin, siten että ionit sinkoavat C:n muotoisesta loukun sisäkaaresta ulos keskittyvänä suihkuna orbitrapiin.[8]
ICR ja FTICR
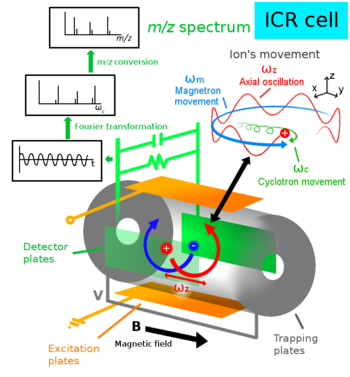
ICR (engl. ion cyclotron resonance) on ioniloukku, jossa ionien erottelu ja analyysi perustuu ionien tässä yhteydessä syklotroni liikkeiksi kutsuttujen resonanssitaajuuksien eroihin. Kaikki laitteeseen syötetyt tutkittavat ionit pysyvät laitteessa analyysin ajan, eivätkä ne haluttaessa törmää mihinkään. ICR sieppaa ionit ICR-soluun muuttumattomaan (staattiseen) ja tasalaatuiseen (homogeeniseen) magneettikenttään, joka on saatu aikaan yleensä suprajohtavalla magneetilla. Kentässä ionit ajetaan kiertävään liikkeeseen massa-varaus suhteen m/z selvittämiseksi.[1]
Modernien Fourierin muunnosta käyttävien FTICR:ien (engl. fourier tranformation) resoluutiot ovat erittäin korkeita ja ne havaitsevat erittäin pieniä ainepitoisuuksia. FTICR:t pystyvät parhaimmillaan havaitsemaan jopa 30 tseptomoolin (30*10-21 mol) määriä, eli noin 18 000 molekyyliä litrassa liuotinta. Zmol tarkkuuden saavuttaminen FTICR:llä vaatii käytännössä kuitenkin tutkittavan aineen etukäteen erottelua, konsentrointia ja/tai laitteen tarkkaa optimointia.[9]
Kentän voimakkuus on ICR solussa kaikkialla mahdollisimman sama, jolloin se on yhtälöissä tunnettu tekijä ja selvitettäväksi jää m/z. Ionin liike solussa nimittäin riippuu sen massasta m, varauksesta q (m/q = m/z) ja magneettikentästä B (kentän vahvuus ilmaistaan usein tesloina). Magneettikenttä on voimakkaimmillaan vain keskellä solua ja tätä kompensoidaan muuttamalla jännitettä V solun eri kohdissa. Kompensointia kutsutaan kentän harmonisoinniksi.[1]
Soluun tuodut ionit pakotetaan kiertämään kehää vakionopeudella solun sisällä käyttämällä solun eri puolilla olevia vaihtovirtaan (AC) kytkettyjä toimivia levyjä. Levyjen vaihtovirta saa solun ionit liikkeelle. Kun ionien liikkeen säde on kyllin suuri, vaihtovirran muutostaajuus vakioidaan ja ionien rata pysyy muuttumattomana. Negatiivisesti ja positiivisesti varautuneet ionit kiertävät solussa vastakkaisiin suuntiin. Ionien kiertoliikkeen nopeus riippuu niiden m/z-suhteesta. Samanlaiset ionit kiertävät omina yhtenäisinä pilvinä radoillaan.[1]
Suuri liike solussa on magnetroniliikettä ωm. Pienempi liike on syklotroniliikettä ωc. Ioni liikkuu myös solussa pitkittäissuuntaisesti ωz. Liikkeiden taajuudet ovat ωm << ωz << ωc suhteessa toisiinsa.[1]
Suurimman taajuuden syklotroniliike ωc halutaan tavallisesti mitata ja magnetroniliike ωm häiritsee tätä mittausta. ωm taajuus kasvaa ionin m/z kasvaessa ja johtaa resoluution huonontumiseen.[1]
FTICR:ssä on ICR solun vastakkaisilla puolilla mittauslevyt. Samanlaisten varautuneiden ionien kiertäessä levyn läheltä yhtenäisenä pilvenä, tuottavat ne levyyn sähkövirran muutoksen, joka havaitaan, voimistetaan ja syötetään tietokoneelle. Ioneita on solussa monenlaisia, joten niistä saadaan yhdistetty signaali, jonka signaalit erotetaan matemaattisesti Fourierin muunnoksen avulla m/z-arvoiksi kuvaajaan (spektriin).[1]
TOF
Lentoajan (engl. time-of-flight, TOF) analysaattorit perustuvat ionien liikenopeuksien eroihin. Yksinkertaisimmissa lineaarisissa TOF-analysaattoreissa (LTOF) ionisaattorilta saapuvat ionit keskitetään sähköistettyjen reiällisten levyjen avulla ohueksi virraksi ja ne kiihdytetään tiettyyn vakionopeuteen. Tämän jälkeen ionit saapuvat tilaan, jossa niihin ei vaikuteta sähkökentän avulla. Tällöin ionit alkavat erottua toisistaan liikenopeuksiensa erojen vuoksi. Liikenopeuksien erot perustuvat ionien m/z-eroihin ja suurimman m/z omaavat ionit liikkuvat hitaimmin sähkökentättömällä alueella. Ionit saapuvat havaitsimelle. Ionien lentoaikoja vertailemalla lasketaan kunkin havaitsimelta saadun ionisignaalin m/z-arvot.[1]
TOF-analysaattorit on usein yhdistetty MALDI-ionisaattoriin TOF-MALDI-yhdistelmäksi, koska se sopii TOF-analysaattoriin hyvin tuottamansa lyhyen ionisuihkun ansiosta, toisin kuin esimerkiksi ESI. TOF-MALDI-massaspektrometrit kykenevät havaitsemaan parhaimmillaan yli 300 000 daltonin ioneita satojen attomoolien (10-18 mol) pitoisuuksissa. Laitteet ovat siis hyvin herkkiä.[1]
Magneettiset ja sähköstaattiset sektorianalysaattorit

Sektorianalysaattorit luokitellaan magneettisiin (B) ja sähköstaattisiin (E) sektorianalysaattoreihin. Magneettisissa analysaattoreissa (B) ionit erotellaan magneettikentän avulla niiden liikemäärien (liikemomenttien) erojen perusteella. Erot johtuvat eriävistä m/z-arvoista. Ionit kiihdytetään jännitteen (V) avulla samaan nopeuteen putkeen, jossa on voimakas magneettikenttä. Kentän vaikutuksesta pienimpien m/z omaavien ionien liikeradat kaareutuvat eniten ja suurimpien vähiten. Putken ulostulon kohdalta tulleet ionit voidaan havaita ja niiden m/z-arvot laskea, jos tunnetaan magneettikentän voimakkuus ja kiihdyttimen jännite. Jännite-eroa voidaan muuttaa, jolloin kunkin eri m/z-ionien virrat voidaan kohdistaa paikallaan olevaan ionien havaitsimeen.[1]
Sähköstaattiset analysaattorit (E) erottavat ionit niiden eriävien m/z-arvojen perusteella sähkökenttää käyttäen. Niissä on eri jännitteen omaavat eri napaiset yleensä kaarevat levyt, joiden väliin vakionopeuksinen ionisuihku ohjataan. Ionit eriävät toisistaan niiden liike-energian (kineettisen energian) erojen myötä eri m/z omaaviksi suihkuiksi, jotka voidaan havaita.[1]
B- ja E-analysaattoreita voidaan yhdistää erilaisiksi yhdistelmiksi kuten BE, EB, BEB jne.[1]
Taulukko yleisten massa-analysaattorien tyypillisistä ominaisuuksista[10]
| Analysaattori | Puoliarvoleveyden (FWHM) resoluutio | Massatarkkuus (ppm) | Skannausnopeus | Maksimi m/z | Dynaaminen alue (pienimmän ja suurimman mahdollisen m/z-mittausarvon välinen suhde) | |
|---|---|---|---|---|---|---|
| Pienen resoluution laitteet | ||||||
| QqQ (kvadrupoli) | 7500 (kun m/z 508) | 5-500 ppm | 5000 Da/s | 3000 m/z | 105-106 | |
| IT/LIT (ioniloukku) | 10 000 | 50-500 ppm | 33 000 Da/s | 4000 m/z | 104 | |
| Qq-LIT | 9200 (kun m/z 922) | 50-500 ppm | 20 000 Da/s | 2000 m/z | 105-106 | |
| Suuren resoluution laitteet | ||||||
| TOF | TOF | 20 000 (kun m/z 1000) | < 1-2 ppm (sisäinen kalibraatio) | 40 Hz | 20 000 m/z | 104-105 |
| Qq-TOF | 60 000 (kun m/z 1222) | < 1-2 ppm (sis. kal.) | 100 Hz | 40 000 m/z | 104-105 | |
| IT-TOF | 10 000 (kun m/z 1000) | < 2 ppm (sis. kal.) | 10 Hz | 5000 m/z | 103 | |
| Orbitrap | Orbitrap | 140 000 (kun m/z 200) | < 1 ppm (sis. kal.) < 3 ppm (ulkoinen kal.) | 12 Hz 17 500 resoluutiolla (kun m/z 200) | 6000 m/z | 103-104 |
| LTQ-Orbitrap | 240 000 (kun m/z 400) | < 1 ppm (sis. kal.) < 3 ppm (ulk. kal.) | 8 Hz 15 000 resoluutiolla (kun m/z 400) | 4000 m/z | 103-104 | |
| Q-Orbitrap | 140 000 (kun m/z 200) | < 1 ppm (sis. kal.) < 5 ppm (ulk. kal.) | 12 Hz 17 500 resoluutiolla (kun m/z 200) | 4000 m/z | 103-104 | |
| FT-ICR | LTQ-FT 7 teslan magneetti | 750 000 (kun m/z 400) | < 1 ppm (sis. kal.) < 1.2 ppm (ulkoinen kal.) | 1 Hz 100 000 resoluutiolla (kun m/z 400) | 4000 m/z | 103-104 |
| Qq-FT 7 teslan magneetti | 10 000 000 (kun m/z 400) | < 1 ppm (sis. kal.) < 1.5 ppm (ulkoinen kal.) | 1 Hz 250 000 resoluutiolla (kun m/z 400) | 10 000 m/z | 103-104 | |
Fragmentaatiomenetelmät

Fragmentaatiossa pyritään tarkoituksenmukaisesti pilkkomaan ioneita massaspektrometrissä eri menetelmin, jotta saadaan selville rakenteellista tietoa tutkittavista aineista. Fragmentaatiota käytetään usein esimerkiksi peptidien ja suurempien proteiinien tutkimuksessa ja sen avulla voidaan selvittää näiden aminohapposekvenssejä. Fragmentaatiota voidaan käyttää joissakin hybridimassaspektrometreissä.[1]
Törmäysfragmentaatio
Ionien törmäykset kaasun kanssa aiheuttavat ionien fragmentaatiota ja tämä pilkkoutuminen perustuu sidosvärähtelyihin. Tästä yksi menetelmä on CID. CID:ssä (engl. collision-induced dissociation), eli törmäysaktivoidussa dissosiaatiossa (käytetään myös nimitystä CAD) reagoimattomia jalokaasumolekyylejä tuodaan MS:n vakuumiin ja ionit törmäävät näihin pilkkoutuen. CID:ssä ionin liike-energia muuttuu ionin sisäiseksi energiaksi, kun törmäytetään samalla nopeudella liikkuvat ioni ja kaasu. Katkeaminen CID:ssä voi olla homolyyttistä (radikaaleja muodostuu) tai heterolyyttistä (ioneita muodostuu).[1]
Reagoimattomia jalokaasuja käytetään, vaikka ne ovat keveitä verrattuna esimerkiksi happeen. Happi muodostaa radikaaleja, ja muutkin ei-jalokaasut reagoivat. Raskaat jalokaasut, kuten Xe, ovat hyviä, sillä niillä on enemmän liike-energiaa painonsa vuoksi.[1]
Kaasujen törmäyksiin perustuvat menetelmät ovat verrattain epätarkkoja.[1]
Fotonifragmentaatio
Fotonien käyttö fragmentaatiossa on spesifisempää kuin kaasujen käyttö. FTICR MS:sää käytettäessä suurimpana etuna esimerkiksi IRMPD:ssä (engl. infrared multiphoton dissociation) CID:iin verrattuna on analyysin nopeus.[1]
Elektronifragmentaatio
ECD:ssä (engl. electron-capture dissociation) fragmentoidaan matalan energian (< 0.2 eV) elektronien avulla ioneita. Menetelmä on spesifinen ja toimii radikaalireaktioiden kautta, sillä ionin siepatessa yksittäisen elektronin muodostuu radikaali kationi, joka voi dissosioitua. ECD:tä käytetään monivarauksellisten positiivisten ionien fragmentointiin. ECD on yleisesti käytetty ja sopii erityisesti isoille ioneille. Matalan energian elektronit menetelmään tuo katodi.[1]
Dissosioituminen on nopeaa muihin menetelmiin verrattuna, joten mitään varauksen siirtymiä ei ehdi tapahtua (katkeaminen on siis pitkälti sidosenergiasta riippumatonta) ja sidos katkeaa helpoiten siitä kohtaa, johon protoni on siirtynyt. Elektronit ovat kuitenkin pienempiä kuin esim. CID:ssä käytetyt jalokaasuatomit, joten törmäyksiä tapahtuu suhteessa muihin menetelmiin vähän. ECD ei sovellu ioniloukuille, koska niiden voimakas sähkökenttä vaikuttaa elektronien liikkeeseen vähentäen niiden lämpöenergiaa, jolloin ne lopulta sinkoutuvat ulos loukusta. Ioniloukuille sopii ECD:n muunnelma ETD (engl. electron transfer dissociation).[1]
Taulukko fragmentaatiomenetelmistä[1]
| Metodi (fragmentoija) | Fragmentaatio perustuu | Fragmentoijien energia | Metodille sopivat laitteet |
| CID (kaasu) | sidosvärähtelyihin | Matala | QqQ, IT, QqTOF, QqIT, FTICR |
| Korkea | TOF, B (mm. EBEB) | ||
| SID (kaasu) | sidosvärähtelyihin | Matala | QqQ, IT, (FT)ICR, BqQ |
| Korkea | TOF | ||
| IRMPD (fotonit) | sidosvärähtelyihin | Matala | FTICR, IT |
| ECD (elektronit) | elektronien virittymiseen | Matala | FTICR |
| ETD (elektronit) | elektronien virittymiseen | Matala | IT |
| Fragmentaatiomenetelmiä:
Collision induced dissociation (CID), Surface-induced dissociation (SID), Infrared multiphoton dissociation (IRMPD), Blackbody infrared radiative dissociation (BIRD), Electron capture dissociation (ECD), Electron detachment dissociation (EDD), Electron transfer dissociation (ETD) ja Electron-induced dissociation (EID). Laitteiden nimien selvennykset: ICR: ionisyklotroniresonanssi, IT: ioniloukku (trap), BqQ: hybridi, jossa magneetti (B), kvadrupoli non-RF MS (q) ja kvadrupoli MS Q) sekä TOF: lentoaika-analysaattori. | |||
Lähteet
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl de Hoffmann, Edmond & Stroobant, Vincent: Mass Spectrometry Principles and Applications, 3. painos. John Wiley & Sons, 29.10.2007. ISBN 978-0-470-03310-4. Teoksen verkkoversio.
- ↑ Murray, Kermit K., Boyd, Robert K., Eberlin, Marcos N., Langley, G. John, Li, Liang, Naito, Yasuhide: Definitions of terms relating to mass spectrometry (IUPAC Recommendations 2013). Pure and Applied Chemistry, 6.6.2013, nro 7. doi:10.1351/PAC-REC-06-04-06. ISSN 0033-4545. Artikkelin verkkoversio. en
- ↑ a b c d e f g h Kermit K. Murray, Robert K. Boyd, Marcos N. Eberlin, G. John Langley, Liang Li, Yasuhide Naito: Definitions of terms relating to mass spectrometry (IUPAC Recommendations 2013). Pure and Applied Chemistry, 6.6.2013, nro 7. doi:10.1351/pac-rec-06-04-06. ISSN 1365-3075. http://www.mssj.jp/glossary/8507x1515.pdf Artikkelin verkkoversio. en
- ↑ a b c Atomic Weights and Isotopic Compositions for All Elements physics.nist.gov. Viitattu 24.4.2017.
- ↑ Steve Nguyen, John B. Fenn: Gas-phase ions of solute species from charged droplets of solutions. Proceedings of the National Academy of Sciences of the United States of America, 23.1.2007, nro 4, s. 1111–1117. PubMed:17213314. doi:10.1073/pnas.0609969104. ISSN 0027-8424. Artikkelin verkkoversio.
- ↑ J Fernandez de la Mora: Electrospray ionization of large multiply charged species proceeds via Dole’s charged residue mechanism. Analytica Chimica Acta, 1.2.2000, nro 1, s. 93–104. doi:10.1016/S0003-2670(99)00601-7. Artikkelin verkkoversio.
- ↑ Lars Konermann, Elias Ahadi, Antony D. Rodriguez, Siavash Vahidi: Unraveling the Mechanism of Electrospray Ionization. Analytical Chemistry, 2.1.2013, nro 1, s. 2–9. doi:10.1021/ac302789c. ISSN 0003-2700. Artikkelin verkkoversio.
- ↑ Jesper V. Olsen, Jae C. Schwartz, Jens Griep-Raming, Michael L. Nielsen, Eugen Damoc, Eduard Denisov: A Dual Pressure Linear Ion Trap Orbitrap Instrument with Very High Sequencing Speed. Molecular & Cellular Proteomics : MCP, 7.4.2017, nro 12, s. 2759–2769. PubMed:19828875. doi:10.1074/mcp.M900375-MCP200. ISSN 1535-9476. Artikkelin verkkoversio.
- ↑ M. E. Belov, M. V. Gorshkov, H. R. Udseth, G. A. Anderson, R. D. Smith: Zeptomole-sensitivity electrospray ionization--Fourier transform ion cyclotron resonance mass spectrometry of proteins. Analytical Chemistry, 15.5.2000, nro 10, s. 2271–2279. PubMed:10845374. ISSN 0003-2700. Artikkelin verkkoversio.
- ↑ Christophe Junot, François Fenaille, Benoit Colsch, François Bécher: High resolution mass spectrometry based techniques at the crossroads of metabolic pathways. Mass Spectrometry Reviews, 1.11.2014, nro 6, s. 471–500. doi:10.1002/mas.21401. ISSN 1098-2787. Artikkelin verkkoversio. en