Oksianioni
Oksianioni eli oksoanioni on mikä tahansa ioni, jonka kemiallinen kaava on muotoa AxOyz-, missä O merkitsee happea, A jotakin muuta alkuainetta sekä x, y ja z kokonaislukuja.
Suurin osa tunnetuista alkuaineista voi muodostaa oksianionin.[1] Yksinkertaisten oksianionien kaavan määrittää oktettisääntö. Kutakin oksianionia vastaava happihappo on HzAxOy. Kondensoituneiden oksianionien voidaan käsittää muodostuvan monitahokkaan muotoisista AOn -yksiköistä, joissa monitahokkailla on ainakin yksi yhteinen kärki tai särmä.
Monomeeriset oksianionit
[muokkaa | muokkaa wikitekstiä]Monomeeristen oksianionien, AOnm- kaavan määrittää alkuaineen A hapetusluku ja sen sijainti jaksollisessa järjestelmässä. Toisen jakson alkuaineilla suurin mahdollinen koordinaatioluku on 4. Yksikään tämän jakson alkuaineista ei kuitenkaan muodosta oksianionia tällä koordinaatioluvulla. Sen sijaan karbonaatti- (CO32-) ja nitraatti-ionilla (NO3- on kolmiomainen tasorakenne, jossa on π-sidos keskusatomin ja happiatomien välillä. Tätä π-sidosta suosii se seikka, että keskusatomi ja happiatomi ovat suunnilleen saman kokoisia.
Jaksollisen järjestelmän kolmannen jakson alkuaineet piistä klooriin sen sijaan muodostavat tetraedrisiä oksianioneja. Tetraedrinen ortosilikaatti-ioni SiO44- esiintyy joissakin silikaattimineraaleissa, esimerkiksi oliviinissa, [Mg,Fe]SiO4, mutta anioni ei esiinny irrallisena, sillä kiinteässä tilassa kationit ympäröivät tetraedrisesti jokaista tämän ionin happiatomia. Fosfaatti- (PO43-), sulfaatti- (SO42- ja perkloraatti-ioneja (ClO4-) esiintyvät monissa suoloissa. Samat alkuaineet voivat kuitenkin muodostaa oksianioneja myös alemmilla hapetusluvuillaan. Sellaisetkin noudattavat usein oktettisääntöä, jonka perusteella niiden kaavat voidaan usein päätellä. Esimerkiksi kloorilla on hapetusluvulla V esiintyessään kaksi valenssielektronia, jolloin se voi ottaa oksidi-ioneilta vastaan kolme elektroniparia sidoselektroneiksi muodostaen oksianionin. Muodostuvan ionin varaus on +5 − 3 × 2 = −1, ja niinpä ionin kaava on ClO3-. VSEPR-teorian mukaan on tämän ionin voidaan olettaa olevan muodoltaan pyramidimainen, ja siinä on kolme sidoselektroniparia sekä yksi vapaa elektronipari. Samaan tapaan kloori(III):n oksianionin kaava on ClO2-, ja siinä on kaksi vapaata elektroniparia sekä kaksi sidoselektroniparia. Kloori muodostaa seuraavat oksianionit:
| Hapetusluku | Nimi | Kaava | Kuva |
|---|---|---|---|
| +1 | hypokloriitti-ioni | ClO− | 
|
| +3 | Kloriitti-ioni | ClO2− | 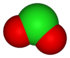
|
| +5 | Kloraatti-ioni | ClO3− | 
|
| +7 | Perkloraatti-ioni | ClO4− | 
|
Neljännen ja sen jälkeisten jaksojen alkuaineilla 6-koordinaatiokin on mahdollista, mutta oktaedrisia oksianioneja ei tunneta, sillä niillä olisi liian suuri sähkövaraus. Niinpä molybdeeni(VI) ei muodosta ionia MoO66-, mutta se muodostaa tetraedrisen molybdaattianionin, MoO42-. MoO6 -yksiköitä esiintyy vain kondensoituneissa molybdaateissa. Myös täysin protonoituneita rakenteeltaan oktaedrisia oksianioneja on olemassa, esimerkiksi Sn(OH)62- ja Sb(OH)6-. Lisäksi ortoperjodaatti voi esiintyä vain ainakin osittain protonoituneena muodossa H3IO62- <=> H2IO63-, tämän reaktion pKa-arvon ollessa 11,60.[2][3]
Nimistö
[muokkaa | muokkaa wikitekstiä]- Katso myös: Happihappo#Happihappojen nimet
Monomeeriset oksianionit nimetään seuraavien sääntöjen mukaan.
Oksianionin nimi johdetaan keskusatomina olevan alkuaineen latinalaisesta nimestä. Seuraavassa jaksollien järjestelmän ryhmille (sarakkeille) käytetään vanhaa numerointikäytäntöä, jonka mukaan nykyisiä ryhmiä 13-17 nimitettiin III - VII pääryhmiksi (III b - VII b), ja vastaavasti nykyisille ryhmille ryhmä 3-7 käytettiin merkintäjä 3a - 7a.
- Jos keskusatomi ei kuulu VII (tai 17.) ryhmään
| Keskusatomin hapetusluku | Nimen muoto | Esimerkkejä |
|---|---|---|
| = ryhmän numero | *-aatti | Boraatti (BO33-), karbonaatti (CO32-), nitraatti (NO3-), fosfaatti (PO43-), kromaatti (CrO42-), arsenaatti (AsO43-), ferraatti (FeO42-) |
| = ryhmän numero − 2 | *-iitti | Nitriitti (NO2-), fosfiitti (PO33-), sulfiitti (SO32-, arseniitti (AsO33-) |
| = ryhmän numero − 4 | hypo-*-iitti | Hypofosfiitti (PO23-), hyposulfiitti (SO22-) |
| Keskusatomin hapetusluku | Nimen muoto | Esimerkkejä |
|---|---|---|
| 7 (=ryhmän numero) | per-*-aatti | Perkloraatti (ClO4-), perbromaatti (BrO4-), perjodaatti (IO4-), permanganaatti (MnO4-) |
| 5 (=ryhmän numero − 2) | *-aatti | Kloraatti (ClO3-), bromaatti (BrO3-), jodaatti (IO3-) |
| 3 (=ryhmän numero − 4) | *-iitti | kloriitti (ClO2-), bromiitti (BrO2-) |
| 1 (=ryhmän numero − 6) | hypo-*-iitti | Hypokloriitti (ClO-), hypobromiitti (BrO−) |
Eri kielissä nämä nimet esiintyvät jossakin määrin toisistaan poikkeavissa muodossa. Esimerkiksi englannin kielessä suomen kielen loppupäätteitä -aatti ja -iitti vastaavat loppupäätteet -ate ja -ite.
Kondensaatioreaktiot
[muokkaa | muokkaa wikitekstiä]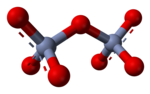
Vesiliuoksissa suurivarauksiset oksianionit voivat yhdistyä kondensoitumalla suuremmiksi ioneiksi, jolloin niistä samalla lohkeaa vettä. Esimerkiksi dikromaatti-ioni (Cr2O7) syntyy kahdesta kromaatti-ionista seuraavan reaktion tuloksena:
- 2 CrO42- + 2 H+ <=> Cr2O72- + H2O
Reaktion seurauksena anionin varaustiheys pienenee ja hydroniumionien (H3O+) lukumäärä vähenee. Samalla liuoksen järjestyneisyyden aste pienenee ja entropia kasvaa jonkin verran, minkä vuoksi Gibbsin vapaa energia tulee negatiivisemmaksi, mikä edistää tätä reaktiota. Tämä on esimerkki happo-emäsreaktiota, jossa monomeerinen oksianioni toimii emäksenä ja kondensoitunut oksianioni sen konjugaattihappona. Reaktion käänteisreaktio on hydrolyysi jossa emäksenä toimiva vesimolekyyli hajoaa.
Kondensoituminen voi jatkua pitemmällekin, varsinkin jos anionilla on suurempi varaus. Näin tapahtuu esimerkiksi adenosiinitrifosfaatin muodostuessa soluissa.
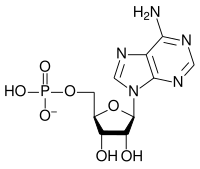
|

|
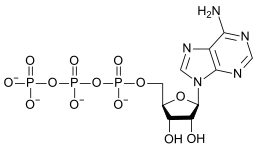
|
| AMP | ADP | ATP |
ATP:n hajoaminen ADP:ksi on hydrolyysireaktio, jolla on suuri merkitys energian lähteenä biologisissa systeemeissä.
Monimutkaisemmat silikaatti-ionit voidaan teoreettisesti käsittää muodostuneiksi ortosilikaatti-ioneista (SiO44-), jotka ovat kondensoituneet niin, että niissä ainakin osa happiatomeista on yhteisiä useammalle piiatomeille. Luonnossa useimmat silikaattimineraalit ovat kuitenkin syntyneet päinvastoin dekondensaation tuloksena piidioksidin reagoidessa emäksisten oksidien kanssa. Tätäkin reaktiota voidaan pitää happo-emäsreaktiona, mikäli hapot käsitetään Luxin ja Floodin esittämän teorian mukaisesti oksidi-ionien (O2-) vastaanottajiksi ja emäkset niiden luovuttajiksi. Esimerkiksi:
- CaO (emäs) + SiO2 (happo) → CaSiO3
Polyoksianionien rakenteet ja kaavat
[muokkaa | muokkaa wikitekstiä]
Polyoksianioni on polymeroitunut oksianioni, jossa useammat tyyppi' MOn olevat monitahokkaat ovat yhdistyneet toisiinsa niin, että niillä on yhteisä kärkiä tai särmiä.[4] Jos monitahokkaan kärjistä kaksi on yhteisiä viereisten monitahokkaiden kanssa, syntyvät rakenne on ketju tai rengas. Lyhyitä ketjuja esiintyy esimerkiksi polyfosfaateissa. Inosilikaateissa kuten pyrokseeneissa on pitkä ketju SiO4-tetraedrejä, joista jokaisen kärjistä kaksi on yhteistä viereisten tetraedrien kanssa. Sama rakenne esiintyy niin sanotuissa metavanadaateissa, esimerkiksi ammoniummetavanadaatissa, NH4VO3.
Inosilikaateissa esiintyvän anionin (metasilikaatti-ionin) kaava voidaan johtaa seuraavasti: Ajatellaan, että jokainen piiatomi olisi Si4+-ioni ja jokainen happiatomi O2- -ioni. Jokainen tällaiseen ajateltuun pii-ioniin liittyy neljä oksidi-ionia, joista kaksi on yhteisiä viereisten pii-ionien kanssa. Kaksi viimeksi mainittua kuuluu siis vain puoliksi yhteen kunkin pii-ionin kanssa. Näin ketjumaisen anionin stoikiometria ja varaus ovat:
- Stoikiometria: Si + 2 O + (2 × ) O = SiO3
- Varaus: +4 + (2 × −2) + (2 × ( × −2)) = −2.
Rengas voidaan käsittää ketjuksi, jonka molemmat päät on yhdistetty toisiinsa. Sellainen on esimerkiksi syklinen trifosfaatti-ioni P3O93-.
Jos monitahokkailla on kolme yhteistä kärkeä, rakenne laajenee kahteen ulottuvuuteen. Amfiboleissa, esimerkiksi asbestissa kahta ketjua sitovat toisiinsa yhteiset kolmannet kärjet vuorotellen kummassakin ketjussa. Tällaisen rakenteen ideaalinen kaava on Si4O116-, ja suoraviivainen ketjurakenne selittää näiden mineraalien kuitumaisen rakenteen. Kolme yhteistä kärkeä voi johtaa levymaiseen rakenteeseen kuten esimerkiksi kiilteessä, Si2O52-, jossa jokaiseen piiatomiin liitty yksi "oma" happiatomi ja kolme muuta, jotka ovat yhteisiä naapuriatomien kanssa. Kiteytynyt kiille voidaan lohkaista hyvin ohuiksi levyiksi.
Jos tetraedrin kaikki happiatomit ovat yhteisä viereisten tetraedrien kanssa, saadaan kolmiulotteinen rakenne kuten esimerkiksi kvartsissa. Aluminosilikaatit ovat mineraaleja, joissa osa piiatomiesta on korvattu alumiiniatomeilla. Alumiinin hapetusluku on kuitenkin yhtä pienempi kuin piin, minkä vuoksi kiteissä, joissa osa piiatomeista on tällä tavoin korvautunut, on aina mukana myös muita kationeja. Mahdollisia yhdistelmärakenteita on erittäin monia, mikä osaltaan selittää, miksi on olemassa niin monia erilaisia aluminosilikaatteja.

Oktaedriset MO6 ovat yleisiä suuremman järjestysluvun omaavien siirtymämetallien oksianioneissa. Joissakin yhdisteissä, esimerkiksi ketjupolymeerisen ionin Mo2O72- suoloissa, on sekä tetraedrisiä että oktaedrisiä yksikköjä.[5][6] Yhteisiä särmiä esiintyy yleisesti ioneilla, joissa on oktaedrisia rakenneyksiköitä ja oktaedtit ovat epäjärjestyksessä niin, että yksikköjä toisiinsa sitovien happiatomien jännitys pienenee. Tämä johtaa polyoksometalaatteina tunnettuihin kolmiulotteisiin rakenteisiin. Tyypillinen esimerkki tästä on fosmomolybdaatti-ionin Kegginin rakenne. Yhteiset särmät ovat tehokas keino sähkövarauksesta aiheutuvan jännityksen pienentämiseksi, kuten osoittaa seuraava kahden oktaedrin hypoteettinen kondensaatioreaktio:
- MO6n- + 4 H+ → Mo2O10(n-4)- + 2 H2O
Tässä jokaisen M-atomin keskimääräinen varaus pienee kaksi yksikköä. Yhteisten särmien tehon osoittaa seuraava reaktio, joka tapahtuu, kun molybdaatin alkaliseen vesiluokseen lisättään happoa:
- 7 MO42- + 8 H+ ⇄ Mo7O246- + 4 H2O.
Tetraedrinen molybdaatti-ioni muuttuu ensin seitsemän toisiinsa kärjistä liittyvän oktaedrin yhdistelmäksi[6][7], jossa kunkin molybdeeniatomin varaus on keskimäärin . Tämä heptamolybdaattirypäs on niin vakaa, että ryppäitä, joissa on 2–6 molybdaattiyksikköä, ei ole havaittu, vaikka niitä epäilemättä muodostuu reaktion välivaiheina.
Oksianionien happo- ja emäsluonne
[muokkaa | muokkaa wikitekstiä]Useimmat oksianionit ovat heikkoja emäksiä, ja ne voidaan protonoida niin, että saadaan happoja tai happamia suoloja. Esimerkiksi fosfaatti-ioni voidaan protonoida kolmessa peräkkisessä vaiheessa niin, että lopulta saadaan fosforihappoa:
- PO43- + H+ => HPO42-
- HPO42- + H+ => H2PO42-
- H2PO41- + H+ => H3PO42-


Minkä verran protonoitumista vesiliuoksessa tapahtuu, riippuu syntyvän hapon happovakiosta ja liuoksen pH:sta. Esimerkiksi adenosiinimonofosfaatin (AMP) pKa-arvo on 6,21[8], minkä vuoksi neutraaleissa liuoksissa (pH 7) se on noin 10-prosenttisesti protonoitunut. Varauksen neutraloitumispyrkimys vaikuttaa suuresti näihin protonoitumisreaktioihin. Monet yhdenarvoiset anionit kuten perkloraatti- ja permanganaatti-ionit on hyvin vaikea protonoida, ja näin ollen niitä vastaavat hapot ovat vahvoja happoja.
Vaikka esimerkiksi fosforihapon kemiallinen kaava tavallisesti kirjoitetaan muotoon H3PO4, siinä olevat vetyatomit (protonit) ovat kiinnittyneet happiatomeihin, minkä vuoksi kaava voidaan kirjoittaa myös muotoon OP(OH)3, mikä paremmin vastaa molekyylin rakennetta. Vastaavasti rikkihapon kaava voidaan kirjoittaa muotoon O2S(OH)2; tässä muodossa molekyyli esiintyy kaasutilassa.
Fosfiitti-ioni PO33- vahva emäs, ja niinpä siihen on aina kiinnittynyt vähintään yksi protoni. Tässä tapauksessa protoni on sitoutunut suoraan fosforiatomiin, ja ionin rakenne on HPO32-. Tämän ionin muodostuessa fosfiitti-ioni toimii Lewis-emäksenä ja luovuttaa elektroniparin Lewis-hapolle, H+.
Oksianioneja vastaavat happihapot ovat tyypillisesti sitä vahvempia happoja, mitä lähempänä keskusatomi on jaksollisen järjestelmän oikeaa laitaa. Tämä ilmenee erityisen selvästi kolmannessa jaksossa, jossa ortopiihappo (H4SiO4) on sangen heikko happo, mutta perkloorihappo (HClO4) vahvimpia, mitä tunnetaan.[9] Saman alkuaineen eri happihapot taas ovat yleensä sitä vahvempia, mitä enemmän niissä on happiatomeja.[9]

Kuten edellä todettiin, kondensaatioreaktio on samalla happo-emäsreaktio. Monissa systeemeissä voi tapahtua sekä protonoituminen että kondenoituminen. Kromaatti-ioni muodostaa tästä melko yksinkertaisen esimerkin. Oikealla oleva kromaatin predominanssidiagrmmi osoittaa, mikä kromaatin muodoista on vallitsevana minkin pCr- ja pH-arvon vallitessa. Tässä pCr merkitsee kromin konsentraation negatiivista logaritmia ja pH H+-ionin konsentraation negatiivista logaritmia, joka on samalla liuoksen happamuuden mitta. Tässä on kaksi toisistaan riippumatonta tasapainoa. Niiden tasapainovakiot määritellään seuraavasti:[10]
CrO42- + H+ => HCrO4- ; log K1 = 5,89 2 HCrO4- => Cr2O72- + H2O log K2 = 2,05
Predominanssidiagrammi on tulkittava seuraavasti:
- Kromaatti-ioni, CrO42-, on vallitsevana, kun liuoksen pH on korkea. Kun pH kasvaa, kromaatti-ioni tulee yhä vallitsevammaksi, kunnes pH:n ollessa yli 6,75 kaikki liuoksessa oleva kromi on kromaatti-ioneina.
- Kun pH < pK1, dikromaatti-ioni HCrO4 on vallitsevana, jos liuoksen kromipitoisuus on tarpeeksi pieni.
Kun kromin konsentraatio on tarpeeksi suuri eikä liuoksen pH ole kovin korkea, Cr2O7-2 -ioni on vallitsevana.
Molekyyli H2CrO4 ja ioni HCrO2O7- on jätetty pois, koska niitä muodostuu vain pH: ollessa hyvin alhainen.
Predominanssidiagrmmit voivat olla hyvin mutkikkaita, jos syntyy monia polymeerisia reaktiotuotteita[11], kuten vanadaateilla, molybdaateilla ja volframaateilla. Niiden selvittämistä vaikeuttaa myös se että monet korkeammat polymeerit syntyvät erittäin hitaasti niin, että reaktio ei vielä kuukausien kuluttuakaan ole asettunut tasapainotilaan. Tämän vuoksi tasapainovakioissa ja predominanssidiagrammeissa saattaa esiintyä virheitä.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Norman N. Greenwood, Alan Earnshaw: Chemistry of the Elements (2nd ed). Butterworth-Heinemann, 1997. ISBN 978-0-08-037941-8
- ↑ Egon Wiberg, A. F. Holleman: Inorganic chemistry, s. 454. (Englanniksi kääntänyt Mary Eagleson, William Brewer) San Diego, Calif.: Berlin: Academic Press, W. de Gruyter, 2001. ISBN 0123526515
- ↑ Jean-Louis Burgot: Ionic equilibria in analytical chemistry, s. 358. New York: Springer. ISBN 1441983821
- ↑ U. Mueller: Inorganic Structural Chemistry. Wiley, 1993. ISBN 0-471-93717-7
- ↑ I. Lindqvist, O. Hassel, M. Webb, Max Rottenberg: Crystal Structure Studies on Anhydrous Sodium Molybdates and Tungstate. Acta Chem. Scand., Määritä ajankohta! doi:10.3891/acta.chem.scand.04-1066
- ↑ a b A. F. Wells: Structural Inorganic Chemistry, s. 446. Oxford: Clarendon Press, 1962.
- ↑ I. Lindqvist: Arkiv för Kemi, 1950. (ruotsiksi)
- ↑ C. P. da Costa, H. Sigel: Lead(II)-Binding Properties of the 5′-Monophosphates of Adenosine (AMP2−), Inosine (IMP2−), and Guanosine (GMP2−) in Aqueous Solution. Evidence for Nucleobase−Lead(II) Interactions. Inorg. Chem., 2000, nro 26, s. 5985–5993. PubMed:11151499 doi:10.1021/ic0007207
- ↑ a b Antti Kivinen, Osmo Mäkitie: ”Hydroksidit”, Kemia, s. 426–427. Otava, 1993. ISBN 951-1-10136-6
- ↑ F. Brito, J. Ascanioa, S. Mateoa, C. Hernándeza, L. Araujoa, P. Gili, P Martín-Zarzab, S. Domínguea: Equilibria of chromate(VI) species in acid medium and ab initio studies of these species. Polyhedron, 1997, nro 21, s. 3835–3846. doi:10.1016/S0277-5387(97)00128-9
- ↑ M. T. Pope: Heteropoly and Isopoly Oxometalates. Springer, 1983. ISBN 0-387-11889-6
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Oksianioni Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Oksianioni Wikimedia Commonsissa


![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2-}} ][\mathrm {H^{+}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)
![{\displaystyle K_{2}={\frac {[\mathrm {Cr_{2}O_{7}^{2-}} ]}{[\mathrm {HCrO_{4}^{-}} ]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)
