Jalokaasut

Jalokaasut ovat alkuaineita, joilla on uloimmalla elektronikuorellaan täysi oktetti, pois lukien helium, jonka ainoalle elektronikuorelle sopii vain kaksi elektronia.[1][2] Elektronirakenteensa vuoksi ne eivät osallistu helposti kemiallisiin reaktioihin,[1] ja ovat hajuttomia, palamattomia, mauttomia inerttejä kaasuja.[2] Jaksollisessa järjestelmässä jalokaasut muodostavat ryhmän 18 (pääryhmä VIII), ja ne ovat taulukon äärimmäisessä oikeanpuoleisessa sarakkeessa.[3][2] Jalokaasut ovat helium, neon, argon, krypton, ksenon, radon[4] sekä keinotekoinen oganesson.[2][5][6]
Historia
[muokkaa | muokkaa wikitekstiä]Helium
[muokkaa | muokkaa wikitekstiä]
- Pääartikkeli: Helium
Helium (kreik. ἥλιος, helios eli aurinko) löydettiin ensiksi maapallon ulkopuolelta[7], kun tähtitieteilijät Pierre Janssen ja Joseph Lockyer sekä kemisti Edward Frankland vuonna 1868 havaitsivat auringon spektrissä tuntemattoman alkuaineen spektriviivan, jota ei ollut aiemmin tunnettu.[7] Tämä viiva näkyy vain täydellisen auringonpimennyksen aikana, ja sen aallonpituus oli 587,49 nm. Viiva nimettiin D3:ksi, sillä D2 ja D1 ovat natriumin viivoja.[8][9]
Ensimmäisen kerran maan päällä heliumia eristi William Ramsay 23. maaliskuuta 1895, kun hän käsitteli mineraalia nimeltä cleveiitti, joka koostuu pääosin uraanidioksidista (UO2), rikkihapolla, ja erotti syntyvästä kaasusta typen ja hapen, hän arveli löytävänsä argonia, mutta havaitsikin spektrissä kirkkaan keltaisen viivan, joka vastasi auringosta löytynyttä D3 spektriviivaa. Samana vuonna Per Teodor Cleve ja ruotsalainen Abraham Langlet eristivät heliumia niin paljon että pystyivät määrittämään atomipainon, he löysivät sitä itsenäisesti saman aikaisesti kun Ramsay.[8]
Vuonna 1907 osoitettiin, että ydinreaktioissa syntyvät alfahiukkaset ovat heliumytimiä.[7]

Neon
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Neon
Neonin löysivät ensimmäisenä skottilainen kemisti William Ramsay ja englantilainen kemisti Morris Travers vuonna 1898. Se löytyi tutkimalla nesteytettyä ilmaa, melko pian kryptonin jälkeen. He eristivät höyrystyvän kaasun, ja spektroskopian avulla totesivat löytäneensä uuden jalokaasun.[10] Neon on maailmankaikkeuden viidenneksi yleisin alkuaine vedyn, heliumin, hapen ja hiilen jälkeen. Vaikka neonia on runsaasti maailmankaikkeudessa, maapallon ilmakehässä sitä on vain 0,0018 %.[11] Neon nimettiin kreikan kielen mukaan (kreik. νέον, neos eli uusi)[11].
Argon
[muokkaa | muokkaa wikitekstiä]
- Pääartikkeli: Argon
Argonin löysi brittiläinen kemisti Henry Cavendish vuonna 1785. Hän huomasi, että osa ilmasta oli reagoimatonta kaasua.[12] Vuonna 1892 Lordi Rayleigh ja William Ramsay totesivat ilmasta eristetyn typen tiheyden olevan suurempi kuin ammoniakista synteettisesti valmistetun typen. Ramsay poisti ilmasta eristetystä kaasusta kaiken typen kuuman magnesiumin avulla, tehden siitä magnesiumnitridiä, ja jäljelle jäi kaasu, jonka spektrissä oli uusia punaisia ja vihreitä viivoja.[13] Ilmakehä sisältää typen ja hapen jälkeen eniten argonia,[1] jota on ilmassa 0,93 %.[14] Argon on saanut nimensä kreikan kielestä (kreik. ἀργός eli inaktiivinen).[12]
Krypton
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Krypton
Krypton löytyi vuonna 1898, kun William Ramsay ja Morris Traves argonin löydettyään päättelivät että seuraava alkuaine olisi piilossa jäljelle jääneessä seoksessa.[15] He onnistuivat 30. toukokuuta 1898 eristämään sitä nesteytys- ja haihtumisprosesseilla noin 25 cm³. He testasivat sen spektrometrillä, ja totesivat kyseessä olevan uusi, ennen löytämätön, alkuaine. He nimesivät sen kreikan kielen mukaan kryptoniksi (kreik. κρυπτός, kryptos, eli piilotettua tai kätkettyä).[16]
Ksenon
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Ksenon
Ksenon löydettiin vuonna 1898. William Ramsay ja Morris Travers olivat aiemmin eristäneet neonin, argonin ja kryptonin nestemäisestä ilmasta ja miettivät sisältäisikö ilma vielä muita kaasuja. Varakas teollisuusmies Ludwig Mond antoi heidän käyttöönsä uuden koneen nestemäisen ilman käsittelyyn, ja he käyttivät sitä eristääkseen lisää harvinaista ksenonia. He erottivat yhä uudestaan raskaammat kaasut ja saivat lopuksi ksenonia niin paljon, että pystyivät tutkimaan sitä tyhjiöputkessa, jossa se antoi sinisen hehkun. He ymmärsivät löytäneensä vielä yhden jalokaasun. He nimesivät sen kreikan kielen mukaan ksenoniksi (kreik. ξένον, xenon eli outo). Myöhemmin, vuonna 1962, osoittautui, ettei ksenon ollutkaan niin inerttiä kuin muut jalokaasut.[17]
Ksenon on jalokaasuista harvinaisin. Sitä on ilmakehässä noin yksi osa kahdestakymmenestä miljoonasta. [18] Laskennallisesti ksenonia pitäsi kuitenkin olla ilmakehässä 20 kertaa enemmän kuin on havaittu.[1] Marsin ilmakehään verrattuna näyttäisi siltä, että 95 % ksenonista on hävinnyt jonnekin Maan syntymisen jälkeen,[19] Ei tiedetä, onko se kätkeytynyt maaperään, sitoutunut veteen vai hävinnyt maapallolta.[1][19]
Ksenonia eristetään nestemäisestä ilmasta kaupallisiin tarkoituksiin. Isotooppeja 133Xe ja 135Xe valmistetaan neutronisäteilyllä ilmajäähdytteisissä ydinreaktoreissa.[18]
Radon
[muokkaa | muokkaa wikitekstiä]


- Pääartikkeli: Radon
Vuonna 1899 Ernest Rutherford ja Robert B. Owens tekivät havainnon, jonka mukaan torium tuottaa radioaktiivista kaasua. Samana vuonna Pierre ja Marie Curie havaitsivat radiumista lähtevän radonia. Vuonna 1900 Friedrich Ernst Dorn havaitsi, että ampulleihin suljettu radium tuottaa kaasua. He olivat ensimmäisiä, jotka tekivät havaintoja radonista. Pian löydettiin pitkäikäinen isotooppi 222Rn, jonka puoliintumisaika on 3,8 vuorokautta. Se radon, jota Rutherford havaitsi, oli 220Rn, joka puoliintumisaika on vain 56 sekuntia.[20]
Vuonna 1900 Rutherford huomasi että uusi kaasu on mahdollista saada liukenemaan veteen. Vuonna 1908 William Ramsay ja Robert Whytlaw-Grey keräsivät niin paljon kaasua, että pystyivät määrittämään sen ominaisuuksia. He ilmoittivat sen olevan raskain löydetty kaasu.[20] Maapallon ilmakehässä olevat radonpitoisuudet ovat alhaisia johtuen sen isotooppien lyhyistä puoliintumisajoista.[21]
Ensimmäiset radonin terveyshaitat tulivat ilmi, kun sitä louhittiin Yhdysvalloissa kylmän sodan aikana. Uraanikaivoksilla radonpitoisuudet olivat niin suuria, että ne olisivat edellyttäneet kunnollisen ilmastoinnin järjestämistä, jota myös turvallisuussäädökset edellyttivät. Kuitenkaan ei niiden toteutumista valvottu tai noudatettu kovinkaan tarkasti, ja suuret määrät kaivostyöläisiä sairastui keuhkosyöpään sekä muihin radonista aiheutuneisiin sairauksiin.[21]
Radonin vaaroihin havahduttiin vuonna 1984, kun Stanley Watras, joka oli työntekijänä ydinvoimalassa, meni töihin ja säteilymittarit hälyttivät. Hän ei ollut ollut missään tekemisissä polttoainesauvojen kanssa, ja kun säteilyn lähdettä tutkittiin, mentiin lopuksi hänen kotiinsa, jonka kellarista mitattiin korkea radonpitoisuus, noin 100 000 Bq,[21] mikä oli 1 100 kertaa korkeampi kuin hyväksytty taso.[22] Nykyään asuntojen kellareissa mitataan säteilymääriä radoninmittauspurkeilla jos epäillään että asunnossa saattaisivat radonin määrät olla suositeltavaa korkeampia.[23]
Oganesson
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Oganesson
Ryhmän 18 viimeistä alkuainetta numero 118 (oganesson) pystyttiin valmistamaan kolmen atomin verran vuonna 2002.[5][24][25] Oganessonilla on yksi tunnettu radioaktiivinen isotooppi, 294Og, jonka puoliintumisaika on 0,89 millisekuntia.[6][25] Oganesson on kaikista raskain alkuaine, joka on onnistuttu valmistamaan.[26]
Kemialliset ominaisuudet
[muokkaa | muokkaa wikitekstiä]Yleisesti ottaen jalokaasut eivät reagoi kemiallisesti mitenkään. Jalokaasuyhdisteitä on pystytty kyllä saamaan aikaiseksi raskaammilla jalokaasuilla, argonilla, kryptonilla, ksenonilla ja radonilla, joiden ylemmät orbitaalit voivat luovuttaa elektroneja[1][2]. Ainoastaan kryptonin, ksenonin ja radonin tiedetään muodostavan stabiileja yhdisteitä[2]. 1990–2000-lukujen vaihteessa Markku Räsäsen johtama tutkimusryhmä löysi ensimmäisenä maailmassa argonyhdisteen, joka oli –265 °C:n lämpötilassa esiintyvä, mutta erittäin epästabiili argonfluorohydridi (HArF)[1][19] Yhtäkään vakaata helium- tai neonyhdistettä ei ole kyetty valmistamaan[27].
Ksenonia sisältäviä yhdisteitä on pystytty syntetisoimaan useita erilaisia[1]. Syntetisoituja ksenonin fluorideja ovat esimerkiksi XeF2, XeF4 ja XeF6. Näissä fluori toimii hapettimena eli ksenon on osittain positiivisesti varautunut.[28][29] Ksenondifluoridi on epästabiili, herkkä ilmalle ja kosteudelle. Kaikki ksenonfluoridit on suojattava kosteudelta, jotta vältetään ksenonitrioksidin muodostuminen. Se on väritön ja haihtumaton kiinteä aine, joka on vaarallisen räjähtävä kuivana. Sen liuos on vakaa heikko happo, mutta vahva hapettava aine.[30] Ksenon itsessään ei ole myrkyllinen, mutta sen yhdisteet ovat erittäin myrkyllisiä, koska ne ovat voimakkaita hapettavia aineita[17].
Fysikaaliset- ja atomiominaisuudet
[muokkaa | muokkaa wikitekstiä]Jalokaasuilla on erittäin matalat sulamis- ja kiehumispisteet. Myös ryhmän raskaimmat aineet ovat normaaliolosuhteissa yksiatomisia kaasuja.[2]
| Ominaisuus[2] | Helium | Neon | Argon | Krypton | Ksenon | Radon |
|---|---|---|---|---|---|---|
| Tiheys (g/dm3) | 0,17847 | 0,899 | 1,784 | 3,75 | 5,881 | 9,73 |
| Kiehumispiste (°C) | −268,93 | −246,08 | −185,8 | −153,22 | −108 | −61,7 |
| Sulamispiste (°C) | −272,2* | −248,59 | −189,3 | −157,36 | −111,7 | −71 |
| Höyrystymislämpö (kJ/mol) | 0,083 | 1,75 | 6,5 | 9,02 | 12.64 | 17 |
| Liukoisuus veteen 20 °C:ssa (cm3/kg) | 8,61 | 10,5 | 33,6 | 59,4 | 108,1 | 230 |
| Järjestysluku | 2 | 10 | 18 | 36 | 54 | 86 |
| Atomisäde (pm) | 31 | 38 | 71 | 88 | 108 | 120 |
| Ionisoitumisenergia (eV) | 24,587 | 21,565 | 15,759 | 13,999 | 12,129 | 10,747 |
* 25 bar paineessa.
Sovellukset
[muokkaa | muokkaa wikitekstiä]
Jalokaasuja käytetään valaistustekniikassa radioaktiivista radonia lukuun ottamatta. Ensimmäisen kerran neonvaloja käytettiin vuonna 1893 Chicagon maailmannäyttelyssä.[31] Ne kuitenkin alkoivat yleistyä vasta 1910–1920-luvulla, kun ranskalainen insinööri Georges Claude alkoi tehdä niistä mainosvaloja. Fyysikko Heinrich Geissler kehitti 1857 Geisslerin putken, jossa umpinaiseen lasiputkeen johdettu jalokaasu alkoi hohtaa, kun sen läpi johdettiin sähkövirta. Jokainen jalokaasu tuottaa erilaisen värisävyn tämän tyyppiseen loisteputkeen.[31][32]
| Väri | Helium | Neon | Argon | Krypton | Ksenon | Radon |
|---|---|---|---|---|---|---|
| kaasupurkausputkesta lähtevä valon väri[2] |
keltainen |
punainen |
magenta tai sininen |
kellanvihreä |
sinisenvihreä |
− |


Argonia käytetään myös suojakaasuna, kuten hitsauksessa[33] tai hehkulamppujen sisäosissa estämässä hehkuvaa volframilankaa haihtumasta lamppujen sisäosissa. Ennen lamppujen sisäosaan luotiin tyhjiö, jotta hehkulanka ei palaisi poikki. Hehkulamppujen valon värisävyihin kaasuilla ei ole vaikutusta.[34]

Ksenonpolttimoita on käytetty muun muassa majakoissa, elokuvaprojektoreissa ja autojen ajovaloina.[35] Niissä ei ole hehkulankaa, joka saattaisi tärinästä hajota. Niissä on kaksi elektrodia, joiden välissä olevassa säiliössä kaasu on. Mukana on myös metallien suoloja kaasun ominaisuuksien muuttamiseksi sopivaksi. Valon sytyttäminen vaatii noin 25 000 voltin jännitteen, mutta syttymisen jälkeen jännitettä voidaan laskea. Ksenonpolttimon elektrodien välille muodostuva jännite-ero saa aikaan valokaaren, joka hehkuu kirkasta valoa kaasuseoksessa. Ksenonpolttimo ei tuota kylmänä sitä valomäärää minkä se tuottaa lämmettyään, mutta se on jo syttyessään kirkkaampi kuin esimerkiksi halogeenipolttimo.[36][37]
Ionisoitunutta kryptonkaasua sisältävien lamppujen valo on valkoista. Kryptonkaasua sisältävät lamput ovat kirkkaita valkoisia valonlähteitä, jotka ovat hyödyllisiä suurnopeuskuvauksessa, salamavaloissa ja suuritehoisissa lentokenttävaloissa. Lentokenttien reunoilla ja lähestymisvaloina käytetään suuritehoisia kryptonlamppuja, jotka antavat voimakkaan valon. Kryptonkaasu yhdistettynä muihin kaasuihin voidaan lamppujen valon väriä muuttaa vihreästä–keltaiseenselvennä.[38][39][40] Kryptonkaasua käytetään inerttinä täyttökaasuna energiansäästölampuissa ja hehkulampuissa[38] sekä myös laserissa, koska sillä on korkea valoteho spektrin punaisessa päässä.[15][38]

Argonia ja kryptonia on käytetty myös eristyslasien[41] välissä täytekaasuina.[42]
Palamatonta ja ilmaa kevyempää heliumia käytetään helposti syttyvän vedyn sijaan usein ilmapalloissa, sääpalloissa ja kevyissä ilmalaivoissa kantokaasuna.[8][43][44] Sillä on myös käyttöä puolijohteissa, kuituoptiikassa, tutkimuksessa, turvatyynyjen valmistuksessa, vuotojen etsinnässä sekä lämpö- ja pintakäsittelyssä[43][9] sekä myös suojakaasuna, aivan niin kuin argoniakin.[33] Nesteytetyllä heliumilla saadaan aikaan myös erittäin alhaisia lämpötiloja, joten sitä käytetään kylmälaboratorioissa suoritettavissa tutkimuksissa yleensä jäähdytysaineena kuten nestemäistä typpeä.[1] Muista kaasuista poiketen helium pysyy nesteenä lähellä absoluuttista nollapistettäkin normaalipaineessa, koska sen nollapiste-energia on yksinkertaisesti liian suuri. Heliumin kiinteä olomuoto muodostuu vasta erittäin alhaisissa lämpötiloissa ja suuressa paineessa (2,5 MPa eli noin 25 bar ja 0,95 K).[8]
Sukelluksessa käytetään myös jalokaasuja.[45] Tekniikkasukelluksessa käytetään argonia kuivapuvun täyttökaasuna sekä heliumin, typen että hapen erilaisia seoksia sukeltajantaudin välttämiseksi.[46] Vaativassa saturaatiosukelluksessa, joka on käytössä etupäässä öljyteollisuuden rakennus- ja huoltotöissä, joita tehdään jopa 500 metrin syvyydessä,[47] käytetään kaasuseoksia estämään sukeltajantautia.[46]
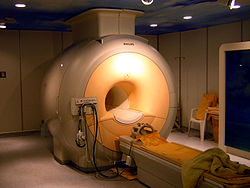
Heliumia käytetään jäähdytysaineena MRI-laitteissa niiden suprajohdemagneettien jäähdytykseen.[7] Neljännes vuosittain tuotetusta heliumista käytetään MRI-laitteissa.[9] MRI-laitteita onkin yritetty kehittää pienempiruokaiseksi heliumin kulutuksessa.[48][49] Myös hiukkaskiihdyttimet käyttävät suuria määriä heliumia isojen magneettiensa jäähdytykseen. Esimerkiksi Large Hadron Collider (suom. suuri hadronitörmäytin) Sveitsin ja Ranskan rajalla CERN:in tutkimuskeskuksessa sisältää 130 tonnia heliumia.[50][51]
Neonia, kryptonia ja ksenonia tuotetaan suurelta osin Ukrainassa ja Venäjällä, joissa 2020-luvulle tapahtui 40--50 % maailman tuotannosta. Kaasut ovat sivutuotteita terästehtaista, joissa erotetaan happi ja typpi ilmasta teräksenvalmistusta varten. 1980-luvulla Neuvostoliitto rakensi terästehtaiden kaasujenerotuslaitteistoihin talteenoton tarkoituksena tuottaa näitä kaasuja lasereita varten, vastineeksi Yhdysvaltain "Tähtien sota" -ohjelmalle.[52] Myöhemmin kaasuja puhdistivat yhtiöt kuten Cryoin, Ingas ja Iceblick Mariupolissa ja Odessassa.[53]
Heliumin uhkaava väheneminen
[muokkaa | muokkaa wikitekstiä]Vuonna 1925 Yhdysvaltain hallitus äänesti strategisen kansallisen heliumvarauksen (National Helium Reserve, NHR) perustamisesta, ja sitä alettiin keräämään kansallisen heliumvarauksen varastoon vanhassa kaivoksessa Amarillossa, Texasissa, mahdollisen sodan varalta ilmalaivoissa käytettäväksi. Sellaista sotaa, jossa olisi tarvittu ilmalaivoja ei kuitenkaan koskaan tullut, mutta 1960 NASA alkoi Apollo-ohjelmassa[9] käyttämään heliumia rakettipolttoaineen tekemisessä.[54] Vuoteen 1995 mennessä varastoihin oli kerätty 800 miljardia litraa kaasua, ja kansallisen heliumvaraus oli velkaantunut 1,4 miljardin dollarin edestä. Järjestelmä päätettiin lopettaa vuonna 1996 ja suurin osa heliumista myytiin sen velkojen maksamiseksi.[9]
Helium on vedyn jälkeen kaikista runsain alkuaine, sitä on 23 % maailmankaikkeuden alkuaineesta, mutta suurin osa siitä on keskittynyt tähtiin. Maapallolla sitä on tilavuusprosentteina on vain 5,2 miljoonasosaa (noin 0,0005 %) pääasiassa siksi, että suurin osa maapallon ilmakehässä olevasta heliumista pakenee avaruuteen sen inerttisyyden ja matalan massan vuoksi.[8] Helium ei ole jakautunut ilmakehään tasaisesti, vaan sitä on eniten ilmakehässä heterosfäärissä.[55] Melkein kaikki maan päällä oleva helium on radioaktiivisten, uraania ja toriumia sisältävien, mineraalien hajoamisen tulos.
Heliumia tuotetaan fraktiotislauksella eli jakotislauksella maakaasusta, jossa sitä saattaa olla jopa 7 %,[8] mutta sitä ei ole tuotettu viime vuosina niin paljon. Yksi syy siihen, että öljy- ja maakaasuyritykset eivät ole halukkaita investoimaan heliumin erottelemiseen maakaasusta on se, ettei Yhdysvallat enää pidä sitä strategisena voimavarana. Tämä on johtanut sen pulaan maailmalla. Heliumista oli pulaa vuosina 2012–2013, koska joitakin isoja laitoksia oli pois käytöstä huoltojen vuoksi.[49] On ennustettu, että nykyisillä käyttöasteilla kaikki helium tunnetuissa varannoissa kulutetaan vuoteen 2030 ja 2040 mennessä.[54]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h i Wallenius, Jarmo: Jalokaasujen kielletyt leikit. Kemia – lehti, 2012, nro 4/2012. Kempulssi Oy. Artikkelin verkkoversio. Viitattu 22.03.2018. (Arkistoitu – Internet Archive)
- ↑ a b c d e f g h i Schrobilgen, Gary J.: Noble gas Encyclopædia Britannica. Viitattu 22.03.2018.
- ↑ 4.2 Halogeenit ja jalokaasut Internetix – Otavan Opisto. 2015. Viitattu 22.03.2018.
- ↑ Wallenius, Jarmo: Jalokaasujen kielletyt leikit. Kemia – lehti, 2012, nro 4/2012. Kempulssi Oy. Artikkelin verkkoversio. Viitattu 22.03.2018. (Arkistoitu – Internet Archive)
- ↑ a b Oganesson Encyclopædia Britannica. Viitattu 22.03.2018.
- ↑ a b Sharp, Tim: Facts About Oganesson (Element 118) Live Science. 1.12.2016. Viitattu 22.03.2018.
- ↑ a b c d Jukka Lukkari: Helium viettää kaksinkertaista merkkipäivää – aine löytyi 1868 auringonpimennyksessä Tekniikka & Talous. 8.1.2018. Viitattu 23.03.2018.
- ↑ a b c d e f Helium The Third Millennium Online. Viitattu 23.03.2018.
- ↑ a b c d e Emsley, John: Helium Education in Chemistry. 1.1.2010. Viitattu 23.03.2018.
- ↑ Neon – Element information, properties and uses Royal Society of Chemistry – Periodic Table. 2017. Viitattu 24.03.2018.
- ↑ a b Neon The Third Millennium Online. Viitattu 23.03.2018.
- ↑ a b Argon The Third Millennium Online. Viitattu 23.03.2018.
- ↑ Argon – Element information, properties and uses Royal Society of Chemistry – Periodic Table. 2017. Viitattu 24.03.2018.
- ↑ Heikki Nevanlinna (toim.): Ilmakehä-abc – Selittävä asiasanasto (s. 9) Ilmatieteen laitos. 2008. Viitattu 24.03.2018.
- ↑ a b Krypton The Third Millennium Online. Viitattu 23.03.2018.
- ↑ Krypton – Element information, properties and uses Royal Society of Chemistry – Periodic Table. 2017. Viitattu 24.03.2018.
- ↑ a b Xenon – Element information, properties and uses Royal Society of Chemistry – Periodic Table. 2017. Viitattu 24.03.2018.
- ↑ a b Xenon The Third Millennium Online. Viitattu 23.03.2018.
- ↑ a b c Tuomas Kangasniemi: Ksenonin puuttuva oksidi löytyi: ratkesiko maapallolta kadonneen kaasun arvoitus? Tekniikka & Talous. 5.3.2011. Viitattu 23.03.2018.
- ↑ a b Radon – Element information, properties and uses Royal Society of Chemistry – Periodic Table. 2017. Viitattu 24.03.2018.
- ↑ a b c Radon The Third Millennium Online. Viitattu 23.03.2018.
- ↑ Anwar Iqbal: Invisible Killer Invades Home Chicago Tribune. 8.10.1987. Viitattu 24.03.2018.
- ↑ Radonmittaukset STUK.fi. Viitattu 24.03.2018.
- ↑ Yu.Ts. et al. (2002): Oganessian "Element 118: results from the first 249Cf + 48Ca experiment". 159.93.28.88. Arkistoitu 22.7.2011. Viitattu 22.03.2018. Arkistolinkki
- ↑ a b Oganesson Element Facts Chemicool.com. 16.6.2016. Viitattu 22.03.2018.
- ↑ Wilson, R. Mark: Oganesson is an oddball among noble gases Physics Today. 5.2.2018. Viitattu 22.03.2018.
- ↑ Lundell, Jan: Ksenonia ja vettä – tulkoon HXeOXeH! eLuova. 3.7.2008. Viitattu 23.03.2018.
- ↑ Tramšek, Melita & Žemva, Boris: Synthesis, Properties and Chemistry of Xenon(II) Fluoride Acta Chimica Slovenica (ACSi). 12.5.2006. Viitattu 22.03.2018.
- ↑ Zelenov, Vladislav V. & Aparina, E. V. & Kashtanov, S. A. & Dodonov, A. F.: Mechanism of the xenon fluoride (XeF2, XeF4, XeF6) reaction with H2O in gas phase ResearchGate. tammikuu 2001. Viitattu 23.03.2018.
- ↑ Xenon Difluoride (XeF2) Reade Advanced Materials. Viitattu 22.03.2018.
- ↑ a b Kuka keksi neonvalot? Historianet.fi. 7.7.2015. Viitattu 23.03.2018.
- ↑ Georges Claude Encyclopædia Britannica. Viitattu 23.03.2018.
- ↑ a b Suojakaasukäsikirja, s. 4-5. Oy AGA Ab. Teoksen verkkoversio (pdf).
- ↑ Hehkulamppu Etälukion kemian sivut. Arkistoitu 13.12.2019. Viitattu 23.03.2018.
- ↑ Woodford, Chris: Xenon lamps and arc lamps Explain that Stuff. 2009, 2017. Viitattu 23.03.2018.
- ↑ Yleistä Xenoneista Xenonkauppa Finland. Viitattu 23.03.2018.
- ↑ Maanteiden sininen valoilmiö peräisin kaasupurkauslampusta Tieteen kuvalehti. 1.9.2009. Viitattu 23.03.2018.
- ↑ a b c Boyd, Alicja: KRYPTON Raci. Arkistoitu 26.2.2017. Viitattu 23.03.2018.
- ↑ Airport Lighting, airport light bulbs, airfield lighting, airport lighting fixtures and accessories 2017. Genesis Lamp Corp.. Viitattu 23.03.2018.
- ↑ The Michigan Technic, s. 46–52. UM Libraries, 1947. Teoksen verkkoversio.
- ↑ Lasisanasto Seloy Oy. 2017. Viitattu 23.03.2018.
- ↑ Hemmilä, Kari & Heimonen, Ismo: Eristyslasin täytekaasun ja lasien toimivuus ja toteaminen 1999. Valtion teknillinen tutkimuskeskus. Viitattu 23.03.2018.
- ↑ a b Helium Air Liquide Finland. 2018. Viitattu 23.03.2018.
- ↑ Lawless, Jill: Giant helium-filled airship Airlander takes off for first time Phys.org. 17.8.2016. Viitattu 23.03.2018.
- ↑ Sukeltamisen luonnolliset rajat Tieteen Kuvalehti. 1.9.2009. Viitattu 23.03.2018.
- ↑ a b Anttila, Matti: Trimix- ja heliox-sukeltaminen Sukellus.info. 20.11.2003. Viitattu 23.03.2018.
- ↑ Heikkinen, Kirsi: Nyt painutaan pohjaan! Tiede -lehti. 26.9.2012. Viitattu 23.03.2018.
- ↑ GE Introduces Freelium Technology to Reduce MRI Helium Needs Imaging Technology News. 6.2.2017. Viitattu 23.03.2018.
- ↑ a b What’s the future for MRI magnets after Helium? Devon Medical. 15.8.2016. Arkistoitu 25.3.2018. Viitattu 23.03.2018.
- ↑ Sarah Charley: LHC filled with liquid helium Symmetry magazine. 12.17.2014. Viitattu 24.03.2018.
- ↑ The damage that derailed the Large Hadron Collider New Scientist. 11.12.2008. Viitattu 24.03.2018.
- ↑ https://www.economist.com/finance-and-economics/2023/03/30/how-rare-gas-supply-adapted-to-russias-war
- ↑ https://spie.org/news/photonics-focus/mayjune-2023/supplying-noble-gases-for-photonics-in-war-time
- ↑ a b Huge newfound deposit of helium will keep MRI scanners running New Scientist. 27.6.2016. Viitattu 24.03.2018.
- ↑ Karttunen, Hannu: Ilmakehän kemiallinen koostumus www.astro.utu.fi. Viitattu 24.03.2018.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Physics Today: A beachhead on the island of stability (englanniksi)
- Atomifysiikan lukio-opetuksesta ja jalokaasujen tutkimisesta elektronispektroskopiaa käyttäen (Arkistoitu – Internet Archive) (pdf)
- Ununoctium nykyisin Oganesson.
- Säteilyturvakeskus: Radon