Essentiaalinen trombosytemia
| Essentiaalinen trombosytemia (ET) | |
|---|---|
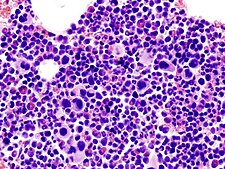 Luuydinnäyte, jossa ilmenee ET:lle ominaisia solumuutoksia |
|
| Ala | hematologia |
| Syyt | tuntematon |
| Oireet | oireeton, verisuonitukokset, verenvuodot |
| Esiintyvyys | 38–57 / 100 000 |
| Diagnosointi | trombosytoosin toteaminen, luuydinnäyte, ET:lle tyypillisten geenivarianttien toteaminen |
| Ehkäisy | keinoja ehkäistä sairastumista ei tunneta |
| Hoito | seuranta, asetyylisalisyylihappo, sytoreduktiivinen lääkehoito |
| Luokitus | |
| ICD-10 | D47.3 |
| Huom! | Tämä artikkeli tarjoaa vain yleistä tietoa aiheesta. Wikipedia ei anna lääketieteellistä neuvontaa. |
Essentiaalinen trombosytemia (ET[1]) on harvinainen krooninen veritauti, jonka taudinkuvaa hallitsee verihiutaleiden liikatuotanto ja hiljalleen voimistuva trombosytoosi. Syytä sairastumiselle ei tunneta, mutta sen kehittyminen liittyy tiettyihin hankinnallisiin geenimutaatioihin.[2] Sairauden ilmaantuvuus vuodessa on 1–2 uutta tapausta 100 000:a henkeä kohden. Sairauden keskimääräinen toteamisikä on noin 40–70 vuotta, ja suurin osa sairastuneista on naisia.[3][2]
Sairaus todetaan usein sattumalöydeksenä, sillä se on tyypillisesti varhaisvaiheessa täysin oireeton.[3][4] Diagnoosi perustuu trombosytoosin ja sairaudelle ominaisten geenivarienttien osoittamiseen sekä luuydinnäytteeseen.[3] Myöhemmin tauti saattaa aiheuttaa erilaisia yleisoireita, joista yleisin on väsymys.[5] Tauti voi myös lisätä riskiä verisuonitukoksille tai verenvuodoille. Harvinaisissa tapauksissa se voi myös muuntua leukemiaksi tai myelofibroosiksi.[2]
Sairauden hoito tähtää komplikaatioiden, kuten verisuonitukosten, estämiseen ja mahdollisten oireiden lievittämiseen. Tukoksia estävänä hoitona käytetään etenkin pieniannoksista asetyylisalisyylihappoa. Liiallisia verihiutalemääriä voidaan puolestaan alentaa hydroksiurean, interferoni-α:n, anagrelidin, busulfaanin tai radiojodihoidon avulla.[3]
Essentiaalinen trombosytemia kuuluu kroonisten myeloproliferatiivisten sairauksien ryhmään.[2] Muihin saman kaltaisiin verisairauksiin verrattuna sen ennuste on melko hyvä, eikä sairastuneiden elinajanodote merkittävästi poikkea muusta väestöstä.[3] Jonkin verran lisäkuolleisuutta aiheuttaa sairauteen liittyvät verisuonitukokset sekä harvemmin sen muuntuminen leukemiaksi.[2]
Etiologia[muokkaa | muokkaa wikitekstiä]
Essentiaalisen trombosytemian tarkka etiologia ei ole tiedossa. Tunnetaan kuitenkin useita geenimutaatioita, jotka altistavat sairauden kehittymiselle. Näitä mutaatioita ovat ainakin JAK2 (Januskinaasi 2), CALR (kalretikuliini), ja MPL (Myeloproliferative Leukemia Virus Oncogene).[3] Niiden tiedetään olevan myös useiden muiden myeloproliferatiivisten verisairauksien taustalla.[2]
Sairaudelle altistavat geenivariantit johtavat luuytimen hematopoieettisten kantasolujen liikatuotantoon, joka lopulta voi johtaa myös sairastumiseen. Pelkkä yksittäinen sairaudelle altistava mutaatio ei kuitenkaan vielä aiheuta verisairautta, sillä mahdollisesti jopa 90 prosenttia aikuisväestöstä kantaa vähintään yhtä sairaudelle tyypillistä geenivarianttia.[2]
Yleisin essentiaaliseen trombosytemiaan sairastuneilla tavattava sille altistava geenivariantti on JAK2-mutaatio JAK2V617F. Kyseinen mutaatio löytyy noin puolelta sairastuneista potilaista. Geenivariantti voi aiheuttaa sairauden sekä esiintyessään vain toisessa kromosomissa heterotsygoottina että esiintyessään molemmissa kromosomeissa homotsygoottina. Homotsygoottiselle mutaatiolle on tyypillistä vakavampi taudinkuva, jolle ominaista on hepariinin indusoiman trombosytemian esiintyminen osana oireistoa.[2]
CALR-mutaatio esiintyy noin neljänneksellä ET-potilaista. Mutaatio on tyypillinen etenkin potilailla, joiden tauti on puhjennut suhteellisen nuorena. Mutaatioon saattaa liittyä myös muita variantteja voimakkaampi trombosytoosin aste, mutta vähäisempi tukostaipumus.[2]
MPL-mutaatiot ovat selvästi kahta edellä mainittua harvinaisempi syy ET:lle. Näitä esiintyy noin 4–5 prosentilla potilaista. Yleisin näistä on MPLW515L/K-mutaatio, mutta myös muita tunnetaan, kuten SH2B3, SF361, U2AF1, TP53 IDH2 ja E2H2. Osalla MPL-mutaatioista on myös ennustearvoa: TP53-mutaatioon liittyvä ET ennustaa suurempaa todennäköisyyttä sairauden muuttumiselle varsinaiseksi leukemiaksi, SF361 ja U2AF1 ennustavat suurempaa riskiä sairastua myelofibroosiin ja U2AF1 ennustaa suurempaa todennäköisyyttä potilaan korkealle verihiutalemäärälle.[2]
Suuri osa ET:n taustalla olevista mutaatioista ei ole perittyjä, vaan ne ovat kehittyneet potilaalle hankinnallisesti. Syitä mutaatioiden muodostumiselle ei tunneta.[1] Poikkeuksen tekee osa JAK2-mutaatioista, jotka saattavat esiintyä myös perinnöllisinä. Toisaalta eräs vaikeaa taudinkuvaa aiheuttava MPL-mutaatio (Ser505Asn) on tavattu perinnöllisenä eräissä italialaisissa suvuissa.[2]
Epidemiologia[muokkaa | muokkaa wikitekstiä]
Essentiaalisen trombosytemian ilmaantuvuus on 1–2 uutta tapausta 100 000 henkeä kohden vuodessa niin Suomessa kuin kansainvälisestikin.[3][2] Yleisin toteamisikä on naisilla 40–50 vuotta ja miehillä 60–70 vuotta.[3] Sairauden prevalenssi on arviolta 38–57 potilasta 100 000 henkeä kohden.[2] Sairastuneista vain noin neljäsosa on miehiä.[3]
Sairaus on osalla potilaista oletettavasti diagnosoimaton, koska sairaus on usein pitkään oireeton tai sen oireet voivat olla epämääräisiä ja moniin eri sairauksiin sopivia. Sairauden tarkkaa esiintyvyyttä onkin hankala arvioida.[3]
Oireet[muokkaa | muokkaa wikitekstiä]
Essentiaalinen trombosytemia on tyypillisesti pitkään täysin oireeton,[3] ja suuri osa diagnooseista tehdään sattumalöydöksenä.[4]
Mikäli tauti havaitaan oireiden perusteella, liittyy se usein jo pidempään kehittyneen taudin aiheuttamiin trombooseihin tai verenvuotoihin.[4] ET saattaa hoitamattomana ja pitkälle edenneenä esimerkiksi aiheuttaa valtimo- tai laskimotukoksia, aivoverenkiertohäiriön, ääreisverenkierron iskemiaan liittyviä oireita, kuten erytromegaliaa, tai tavallisesta poikkeavia verenvuotoja.[3]
Yleensä tukostaipumus on hoitamattomalle ET:lle verenvuotoja tyypillisempi oire. Tukosten esiintyminen ei myöskään suoraan korreloi trombosytoosin asteen kanssa.[4] Verenvuototaipumus alkaa lisääntymään vasta verihiutalemäärän saavuttaessa hyvin korkeita arvoja (> 1 000–1 500 × 109/l), ja ET-potilaan kohonneeseen vuototaipumukseen liittyy usein ET:n rinnalla myös Von Willebrandin tauti.[4][2]
Osa tapauksista saatetaan myös havaita raskauskomplikaatioiden selvittelyn yhteydessä. ET altistaa erilaisille raskauskomplikaatioille, ja potilaan raskautta pidetäänkin riskiraskautena. Raskaana olevaa potilasta yleensä hoidetaan obstetrikkojen ja hematologien yhteistyönä.[3]
Pidemmälle edetessään tauti saattaa aiheuttaa myös erilaisia yleisoireita. Yleisin yksittäinen jokapäiväiseen elämään vaikuttava oire on väsymys, jota esiintyy mahdollisesti jopa 90 prosentilla potilaista. Myös muita yleisoireita esiintyy paljon. Esimerkiksi unettomuutta, puutumisoireita, seksuaalitoiminnan häiriöitä, keskittymisvaikeuksia, yöhikoilua, päänsärkyä tai luustokipuja esiintyy kutakin noin puolella potilaista jossain vaiheessa sairautta. Hieman harvinaisempia ET-potilailla esiintyviä oireita ovat esimerkiksi yskä, kutina, vatsakivut, painon menetys ja kuume.[5]
Harvinaisempana vakavana komplikaationa ET voi kehittyä myelofibroosiksi tai vielä harvemmin muuttua varsinaiseksi leukemiaksi.[3] Riski taudin pahanlaatuistumiselle kasvaa sairausvuosien myötä.[4] Vaikka taudin eteneminen aiheuttaa jonkin verran lisäkuolleisuutta[4], ET-potilaiden elinajanodote ei merkittävästi eroa muun väestön elinajanodotteesta.[3]
Diagnostiset kriteerit[muokkaa | muokkaa wikitekstiä]
Essentiaalisen trombosytemian diagnostiset kriteerit on päivitetty viimeksi vuonna 2016. WHO:n tautiluokituksessa ET:n diagnostiikka yhdistelee kliinistä, geneettistä ja luuytimen morfologista tietoa. ET:tä voidaan pitää myös poissulkudiagnoosina, sillä minkä tahansa muun myelooisen taudin diagnoosi sulkee sen pois.[4]
Nykyään käytettävät diagnostiset pääkriteerit ovat:[3]
- Pitkäkestoinen trombosytoosi on yli 450 x 109/l.
- Luuydinnäyteessä megakaryosyyttien määrä on lisääntynyt ja rakenne poikkeava.
- Muiden myeloproliferatiivisten tautien kriteerit eivät täyty.
- Todetaan JAK2-, CALR- tai MPL-mutaatio.
Diagnoosiin vaaditaan joko kaikki neljä pääkriteeriä tai kolme ensimmäistä pääkriteeriä ja sivukriteeriksi klonaalisen muutoksen osoittaminen tai reaktiivisten syiden poissulku. Lisäksi ilman luuydinbiopsiaa ei diagnoosia voida tehdä.[3]
Muita myeloproliferatiivisia sairauksia, jotka muistuttavat ET:tä ja joiden toteaminen sulkee ET:n pois, ovat polysytemia vera, krooninen myelooinen leukemia ja myelofibroosi.[4][3]
Nykyinen tautiluokitus pitää erityisen tärkeänä tunnistaa ero ET:n ja niin sanotun prefibroottisen idiopaattisen myelofibroosin (pre-PMF) välillä. Oikeaan diagnoosiin päätyminen on tärkeää, sillä pre-PMF on huonompiennusteinen ja muuntuu ET:tä useammin varsinaiseksi myelofibroosiksi tai leukemiaksi. Diagnostinen haaste on se, että ET:n ja pre-PMF:n kohdalla esiintyy usein suurin piirtein saman asteinen trombosytoosi ja sairauksien mutaatioprofiili on lähes yhtenevä. Keskeinen diagnostinen ero sairauksien välillä on pre-PMF:lle tyypillinen luuytimen suurempi kokonaissolukkuus ja lisääntynyt granulosytopoieesi. Koska nämä voidaan todeta vain luuydinnäytteestä, luuydinnäyte on ET-diagnoosin ehdoton kriteeri.[4]
Tyypillisesti diagnoosi tehdään toteamalla trombosytoosi sekä sairaudelle tyypillinen geenivariantti ja ottamalla luuydinnäyte, joka sopii ET:hen eikä sovi muihin myeloproliferatiivisiin sairauksiin. Aina diagnoosiin päätyminen ei kuitenkaan ole suoraviivaista. Esimerkiksi mikäli sopivaa geenivarianttia ei havaita, riittää diagnoosiin reaktiivisten syiden poissulku.[4] Reaktiivinen sekundaarinen trombosytemia voi johtua hyvin moninaisista tiloista, joita ovat esimerkiksi verenvuoto, infektiot, sidekudossairaudet, raju liikunta, synnytys, raudanpuute, kasvaimet ja leikkausten jälkitilat.[3] Reaktiivisen syyn poissulkemiseksi potilasta saatetaan joutua seuraamaan pitkiäkin aikoja ennen ET-diagnoosiin päätymistä.[4]
Hoidon pääperiaatteet[muokkaa | muokkaa wikitekstiä]
Sairaus on krooninen, eikä siihen ole parantavaa hoitoa. Myöskään riskiä taudin etenemiselle leukemiaksi tai myelofibroosiksi ei voida nykyhoidoin vähentää.[4] Hoidon tavoitteena onkin tukos- ja vuotokomplikaatioiden esto sekä mahdollisten oireiden lievittäminen. Tukos- ja vuotokomplikaatioiden ehkäisyn osana myös potilaan muiden kuin ET:hen liittyvien kardiovaskulaaristen riksitekijöiden selvitys ja hoito on tärkeää. Osana näiden riskien vähentämistä potilaan tulee myös pyrkiä lopettamaan mahdollinen tupakointi.[3]
Tukosriskiä ja hoidon tarvetta arvioidaan IPSET (International Prognostic Score for Thrombosis in Essential Thrombocythemia) -pisteytyksellä tai sen uudemmalla muunnoksella revised IPSET -pisteytyksellä. Revised IPSET -pisteytyksen riskitekijöitä ovat yli 60 vuoden ikä, sairastettu verisuonitukos ja JAK2-mutaatio. Pisteytyksen perusteella potilaat jaetaan neljään riskiryhmään, joita ovat:[3]
- erittäin matala riski: ei riskitekijöitä
- matala riski: alle 60-vuotias, ei tukostapahtumia, todettu JAK2-mutaatio
- kohtalainen riski: yli 60-vuotias, ei tukostapahtumia, ei JAK2-mutaatiota
- korkea riski: sairastanut tukostapahtuman tai yli 60-vuotias, jolla JAK2-mutaatio.
Hoidon perusperiaatteena on, että erittäin matalan riskin potilaita, joilla ei ole myöskään muita kardiovaskulaarisia riskitekijöitä, voidaan seurata ilman lääkehoitoa. Matalan riskin potilaiden hoitona käytetään pääsääntöisesti asetyylisalisyylihappoa (ASA), jolla vähennetään verisuonitukosten todennäköisyyttä. Keskinkertaisen riskin potilaille aloitetaan ASA:n rinnalla harkinnan mukaan sytoreduktiivinen eli verisolujen määrää vähentävä lääkitys. Korkean riskin potilailla sytoreduktiivinen lääkitys aloitetaan pääsääntöisesti aina.[3]
Mikäli sytoreduktiiviseen lääkehoitoon päädytään, käytetään lääkeaineena interferonia, hydroksiureaa, anagrelidia tai busulfaania. Koska osa näistä lisää riskiä leukemian tai myelofibroosin kehittymiselle, ei näitä pääsääntöisesti aloiteta nuorille matalan tai erittäin matalan riskin potilaille. Sytoreduktiivisten lääkehoitojen vaihtoehtona voidaan hyvin iäkkäille harkita myös radiofosforihoitoa, jota ei myöskään leukemiariskin takia yleensä aloiteta nuorelle tai hyväkuntoiselle potilaalle, jonka elinajanodote on pitkä.[3]
Lääkehoidot[muokkaa | muokkaa wikitekstiä]
Essentiaalisen trombosytemian lääkehoitojen tavoitteena on vähentää tukostaipumusta sekä vähentää liiallisten verihiutaleiden määrää. Ensimmäiseen tarkoitukseen käytetään asetyylisalisyylihappoa. Verihiutaleiden määrää vähennetään erilaisilla sytoreduktiivisilla lääkkeillä.[3]
Asetyylisalisyylihappo[muokkaa | muokkaa wikitekstiä]
ASA on essentiaalisen trombosytemian peruslääke, joka määrätään lähes kaikille potilaille, joilla on jokin riskitekijä. Erityisesti kardiovaskulaaristen riskitekijöiden esiintyminen puoltaa ASA-hoidon aloittamista. ASA aloitetaan myös aina, jos potilaalla on jo esiintynyt vuoto tai tukos.[3] ASA:n teho ET:n hoidossa perustuu sen kykyyn estää verihiutaleiden tromboksaani A2:ta, joka synnyttää verihiutaleiden taipumuksen aggrekoitua ja joka lisäksi lisää verisuonten supistumista. Tromboksaani A2:n estäminen näin ollen vähentää tukostapahtumia.[6]
Yleensä ASA:a käytetään suhteellisen pieninä 81–100 mg annoksina kerran vuorokaudessa annostellen. Annostelu voi olla myös kahdesti vuorokaudessa, ja tämä annostelutapa saattaa yksittäisten tutkimusten mukaan olla kerran vuorokaudessa otettavaa annosta tehokkaampi. ASA:a käytetään enterotabletteina tai päällystämättöminä tabletteina. Perinteisesti enterotablettien on oletettu aiheuttavan vähemmän maha-suolikanavaan kohdistuvia haittavaikutuksia. Nykytiedon mukaan päällystämättömän tabletin teho on kuitenkin enterotablettia parempi ET:n hoidossa, eikä valmistemuotojen haittavaikutusten välillä ole voitu osoittaa olevan eroja.[6]
ASA:n kykyä vähentää tukostapahtumia ET-potilailla ei ole toistaiseksi dokumentoitu satunnaistetuissa ja kontrolloiduissa kaksoissokkotutkimuksissa. Hoidon teho on alun perin päätelty siitä, että ASA on osoitettu toimivaksi ET:aa läheisesti muistuttavan polysytemia veran hoidossa. Myöhemmin myös ET-potilasaineistoja retrospektiivisesti tarkastelleet tutkimukset ovat osoittaneet ASA:n vähentävän tukostapahtumia tehokkaasti myös ET-potilailla. Teho on erityisesti havaittu JAK2-mutaatiota kantavilla potilailla.[6]
ASA:a ei yleensä aloiteta potilaille, joilla trombosyyttilukema on yli 1 500 x 109/l. Tämä lisää hankinnaisen von Willebrandin taudin kehittymistä ja verenvuotoriskiä, jolloin myös ASA on vasta-aiheinen.[3][6] Osalla potilaista ET:n aiheuttamat tromboosit voivat myös johtaa siihen, että ASA vaihdetaan varsinaiseen antikoagulanttihoitoon. Toisaalta CALR-mutaation aiheuttamaan tautiin liittyy JAK2-mutaatiota pienempi tukosriski[4], eikä ASA:n tehoa CALR-mutaatiota kantavilla potilailla ole voitu luotettavasti osoittaa,[6] jolloin myöskään CALR-varianttia kantaville potilaille ei usein määrätä ASA-lääkitystä.[4]
Hydroksiurea[muokkaa | muokkaa wikitekstiä]
Hydroksiurea on yleisin ET:n hoidossa käytetty sytoreduktiivinen lääke.[3] Nykyisten hoitosuositusten mukaan se on myös ensilinjan hoito, jos ET-potilaalle aloitetaan sytoreduktiivinen lääkitys. Hydroksiurean vaikutus perustuu ribonukleotidireduktaasin estoon, mikä puolestaan häiritsee DNA-synteesiä ja DNA-vaurioiden korjaantumista. Tämä vaikutus estää puolestaan liiallista verihiutaletuotantoa. Hydroksiurean teho ET:n hoidossa on hyvä, ja se on osoittautunut useissa tutkimuksissa joko yhtä tehokkaaksi tai hieman paremmaksi tromboottisten päätetapahtumien estämisessä kuin anagrelidi.[7]
Osa sytoreduktiivisista lääkehoidoista lisää ET-potilaan riskiä kehittää leukemia tai myelofibroosi. Myös hydroksiurean vaikutuksesta potilaan leukemiariskiin keskustellaan, ja aihetta tutkitaan. Tämän hetkinen näyttö viittaa kuitenkin siihen, että hydroksiurea on ET-potilaalle turvallinen ja sen aiheuttama leukemiariski on käytännössä olematon.[3]
Anagrelidi[muokkaa | muokkaa wikitekstiä]
Anagrelidi on ET:n hoidossa teholtaan lähes hydroksiureaan vertautuva sytoreduktiivinen lääke.[7] Koska anagrelidilla on sydänhaittavaikutuksia, ei sen käyttöä iäkkäillä potilailla suositella. Anagrelidi ei kuitenkaan lisää leukemiariskiä, joten se soveltuu erityisen hyvin käytettäväksi nuorille potilaille. Sitä pidetäänkin nuorten potilaiden hoidossa vaihtoehtoisena ensilinjan lääkkeenä. Anagrelidia voidaan käyttää myös toisen linjan hoitona niille potilaille, joille hydroksiurea ei ole sopinut esimerkiksi haittavaikutusten tai huonon vasteen vuoksi.[3]
Anagrelidi on vasta-aiheinen raskausaikana. Se myös saattaa lisätä myelofibroosin riskiä ET-potilailla. Tästä ei kuitenkaan ole olemassa yksiselitteistä näyttöä.[3]
Interferoni-α[muokkaa | muokkaa wikitekstiä]
Interferonin vaikutus perustuu sen immunomodulatiiviseen vaikutukseen. Tältä osin se myös eroaa muista ET-potilaan solutasoa laskevista lääkkeistä. Interferonihoidolla estetään megakaryosyyttisten kantasolujen kasvua, mikä vaikuttaa vuorostaan potilaan verihiutalemääriin.[8]
Interferoni-alfalla saadaan yleensä hyvä hoitovaste, ja noin 90 % interferonilla hoidetuista ET-potilaista hyötyy hoidosta. Hoito säilyy tehokkaana parhaimmillaan useiden vuosien ajan. Interferonihoidolla saatetaan saavuttaa myös taudin remissio, jolloin interferoniannosta voidaan pienentää. Täydellisen remission, jossa potilas pärjää ainakin väliaikaisesti ilman lääkehoitoa, saavuttaa kuitenkin vain noin 12 % potilaista.[8]
ET:n riski muuttua leukemiaksi ei kasva interferonihoidon myötä. Tästä syystä se sopii erityisen hyvin nuorempien potilaiden hoitoon. Toisaalta interferoni aiheuttaa verrattain usein haittavaikutuksia etenkin iäkkäämmille potilaille,[8] joten sen käyttö ensilinjan lääkeenä tulee kyseeseen lähinnä nuorempien potilaiden kohdalla.[3][8]
Busulfaani[muokkaa | muokkaa wikitekstiä]
Busulfaania voidaan käyttää hydroksiurean tai anagrelidin sijasta ET-potilaan sytoreduktiivisena lääkehoitona. Sen käytön on todettu lisäävän ET:n taipumusta edetä varsinaiseksi leukemiaksi. Lisäksi busulfaanin käyttö lisää mahdollisesti myös muiden syöpäsairauksien riskiä. Näistä syistä busulfaania käytetään yleensä vasta toisen linjan hoitona, mikäli esimerkiksi hydroksiurealla ei saavuteta riittävää hoitovastetta tai hydroksiurea on todettu potilaalle sopimattomaksi.[9]
Toisaalta busulfaanin on myös osoitettu olevan sytoreduktiiviselta vaikutukseltaan tehokas lääke, ja sen aiheuttama leukemiariski on todettu olevan tehoon nähden siedettävällä tasolla.[9] Busulfaania voidaankin käyttää etenkin iäkkäämpien potilaiden hoitoon, mikäli hydroksiurealla ei saavuteta riittävää vastetta.[9][4]
Radiofosfori[muokkaa | muokkaa wikitekstiä]
Radiofosforihoidossa potilaalle annostellaan fosforin radioaktiivista P-32-isotooppia. Fosfori kertyy luuytimeen, missä sen tuottama ionisoiva säteily estää liiallista solutuotantoa.[10] Yksittäinen fosforiruiske saattaa tuottaa hyvän hoitovasteen jopa useiksi vuosiksi. Paras vaste saavutetaan yleensä noin puolen vuoden kuluessa hoidosta. Kun solumäärät alkavat jälleen kasvaa, saatetaan hoito tarvittaessa uusia.[4]
Radiofosforihoito lisää ET-potilaan syöpäriskiä. Riski kasvaa erityisesti, jos potilas on saanut myös solunsalpaajahoitoa. Tästä syystä radiofosfori soveltuu lähinnä iäkkäimpien tai huonoennusteisten potilaiden hoitoon. Hoitoa voidaan harkita erityisesti sellaisille loppuvaiheen potilaille, joiden on hankala sitoutua säännölliseen lääkehoitoon.[4]
Ennuste[muokkaa | muokkaa wikitekstiä]
Essentiaalinen trombosytemia on krooninen sairaus, johon ei ole olemassa parantavaa hoitoa.[2][3] Tauti on kuitenkin suhteellisen hyvänlaatuinen, ja potilaiden elinajanodote poikkeaa joko vähän tai ei lainkaan vastaavan ikäisestä muusta väestöstä.[3][2][5] Sairauden ennuste on myös merkittävästi parempi kuin sille läheistä sukua olevan polysytemia veran ennuste.[2]
Elossaoloajan mediaani diagnoosin tekemisestä on 18 vuotta. Alle 60-vuotiaana diagnoosin saaneiden elinajanodote on eräissä tutkimuksissa ollut jopa 33 vuotta.[2] Lisäkuolleisuutta aiheuttaa lähinnä sairauteen liittyvät tukostapahtumat sekä vähemmissä määrin myös sairauden muuntuminen leukemiaksi.[2]
Historia[muokkaa | muokkaa wikitekstiä]
Essentiaalinen trombosytemia tunnistettiin ensimmäisen kerran vuonna 1934. Tuolloin sairautta kuvattiin ”verenvuotoja aiheuttavaksi trombosytemiaksi” (hemorrhagic thrombocythemia). Sairauden tunnistettiin kuuluvan myeloproliferatiivisiin sairauksiin vuonna 1951.[2]
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b Essentiaalinen trombosytemia www.understandoncology.com. Viitattu 31.10.2023.
- ↑ a b c d e f g h i j k l m n o p q r s t Damilola Ashorobi, Pouyan Gohari: Essential Thrombocytosis. Treasure Island (FL): StatPearls Publishing, 2023. Teoksen verkkoversio (viitattu 31.10.2023).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Marjut Kauppila ja Minna Lehto: Lääkärin käsikirja: essentiaalinen trombosytemia. Lääkäriseura Duodecim, 2020.
- ↑ a b c d e f g h i j k l m n o p q r Tero Pirttinen ja Marjatta Sinisalo: Polycythaemia vera ja essentiaalinen trombosytemia Lääketieteellinen aikakauskirja Duodecim. 2017. Lääkäriseura Duodecim. Viitattu 31.10.2023.
- ↑ a b c Vincenzo Accurso, Marco Santoro, Salvatrice Mancuso, Mariasanta Napolitano, Melania Carlisi, Marta Mattana, Chiara Russo, Alessandro Di Stefano, Davide Sirocchi, Sergio Siragusa: The Essential Thrombocythemia in 2020: What We Know and Where We Still Have to Dig Deep. Clinical Medicine Insights: Blood Disorders, 28.12.2020, 13. vsk, s. 2634853520978210. PubMed:33447121. doi:10.1177/2634853520978210. ISSN 1179-545X. Artikkelin verkkoversio.
- ↑ a b c d e Marco Cattaneo: Aspirin in essential thrombocythemia. For whom? What formulation? What regimen?. Haematologica, 12.1.2023, 108. vsk, nro 6, s. 1487–1499. PubMed:36632735. doi:10.3324/haematol.2022.281388. ISSN 0390-6078. Artikkelin verkkoversio.
- ↑ a b Nikolai A. Podoltsev, Mengxin Zhu, Amer M. Zeidan, Rong Wang, Xiaoyi Wang, Amy J. Davidoff, Scott F. Huntington, Smith Giri, Steven D. Gore, Xiaomei Ma: Impact of Hydroxyurea on Survival and Risk of Thrombosis Among Older Patients With Essential Thrombocythemia. Journal of the National Comprehensive Cancer Network, 11.3.2019, 17. vsk, nro 3, s. 211–219. doi:10.6004/jnccn.2018.7095. ISSN 1540-1405. Artikkelin verkkoversio. en-US
- ↑ a b c d Eva Lengfelder, Martin Griesshammer, Rudiger Hehlmann: Interferon-alpha in the Treatment of Essential Thrombocythemia. Leukemia & Lymphoma, 1996-01, 22. vsk, nro sup1, s. 135–142. doi:10.3109/10428199609074371. ISSN 1042-8194. Artikkelin verkkoversio. en
- ↑ a b c Rossella Renso, Andrea Aroldi, Pietro Pioltelli, Carlo Gambacorti-Passerini, Elena Maria Elli: Long-term and low-dose of busulfan is a safe and effective second-line treatment in elderly patients with essential thrombocythemia resistant or intolerant to hydroxyurea. Blood Cancer Journal, 11.6.2018, 8. vsk, nro 6, s. 56. PubMed:29891835. doi:10.1038/s41408-018-0091-6. ISSN 2044-5385. Artikkelin verkkoversio.
- ↑ Radioactive phosphorus therapy www.cancerresearchuk.org. Viitattu 5.2.2024. (englanniksi)