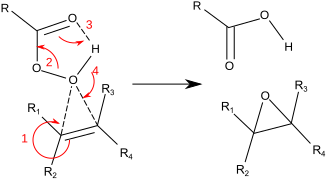Epoksidit

Epoksidit ovat heterosyklisiä eettereitä, joiden rakenteessa on kolmiatominen rengas. Epoksideja voidaan pitää etyleenioksidin eli oksiraanin johdannaisina ja niitä nimitetään myös oksiraaneiksi. Epoksidit ovat hyvin reaktiivisia steerisesti jännittyneen kolmirengasrakenteen vuoksi.[1][2][3]
Valmistus
[muokkaa | muokkaa wikitekstiä]Tyypillisin tapa valmistaa epoksideja on alkeenien hapetus perkarboksyylihapon, kuten perbentsoehapon, m-klooriperbentsoehapon tai trifluoriperetikkahapon avulla. Myös vetyperoksidin emäksistä liuosta voidaan käyttää. Reaktio suoritetaan lisäämällä hapetin alkeenin joukkoon.[3][4] Esimerkissä styreeni hapetetaan perbentsoehapon avulla styreenioksidiksi.
Reaktiossa alkeeni on nukleofiili ja vetyperoksidi tai perkarboksyylihappo on elektrofiili. Reaktio tapahtuu yhtäaikaisprosessina. Tuotteina muodostuu epoksidi ja karboksyylihappo.[4]
Alkeenit, joissa on useita substituentteja reagoivat nopeammin, kuin alkeenit, joissa substituentteja on vähän. Alkyylisubstituentit tekevät alkeenista nukleofiilisemmän, jolloin se reagoi nopeammin elektrofiilisen hapettimen kanssa. Epoksidointi on stereospesifinen reaktio ja cis-alkeeneista muodostuu cis-epoksideja ja trans-alkeeneista trans-epoksideja.[3][4]
Epoksideja voidaan valmistaa myös halohydriineistä tai käyttämällä glysidolia.[3] Kiraalisten eli optiivisesti aktiivisten epoksidien valmistuksessa käytetyin menetelmä on niin kutsuttu Sharpless-epoksidointi. Tässä reaktiossa katalyyttinä toimii titaani-isopropoksidin ja kiraalisen tartraattiesterin, kuten dietyylitartraatin muodostama kompleksi ja hapettimena tert-butyylihydroperoksidi tai kumeenihydroperoksidi.[5]
Reaktioita
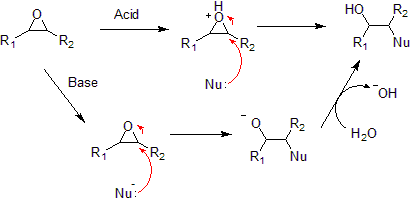
[muokkaa | muokkaa wikitekstiä]Epoksidirengas on steerisesti jännittynyt ja aukeaa helposti. Aukeamista katalysoivat sekä hapot että emäkset ja tuotteena muodostuu β-hydroksiyhdisteitä. Reaktiomekanismit ovat erilaisia kummassakin katalyysityypissä ja tuotteet myös eroavat stereokemialtaan. Happokatalysoidussa reaktiossa epoksidin happiatomi protonoituu, jolloin muodostuu oksoniumioni. Tämän jälkeen nukleofiili reagoi eniten substituoidun hiiliatomin kanssa, jolloin rengasrakenne aukeaa. Emäskatalysoitu renkaan avautuminen on tyypiltään SN2-reaktio ja nukleofiili reagoi vähiten steerisesti estyneen hiiliatomin kanssa.[4][3]
Jos epoksidin aukaisemiseen käytetään alkoksideja muodostuu hydroksyylieettereitä, ammoniakkia käytettäessä tuotteet ovat hydroksyyliamiineja ja fosfiinien kanssa muodostuu fosfiinioksideja.[3]
Epoksidit voidaan myös pelkistää alkoholeiksi käyttämällä litiumalumiinihydridiä. Myös toisiintumisreaktiot karbonyyliyhdisteiksi tai allyylialkoholeiksi ovat mahdollisia.[3]
Epoksideja
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Epoxy compounds IUPAC GoldBook. IUPAC. Viitattu 25.7.2012. (englanniksi)
- ↑ Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 247. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3
- ↑ a b c d e f g Guenter Sienel, Robert Rieth & Kenneth T. Rowbottom: Epoxides, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000 Viitattu 25.07.2012
- ↑ a b c d Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, s. 553. Oxford University Press, 2008. ISBN 978-0-19-850346-0 (englanniksi)
- ↑ Ari M.P. Koskinen: Asymmetric Synthesis of Natural Products, s. 104–106. (2. painos) John Wiley & Sons, 2012. ISBN 978-1-119-97669-1 (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Epoksidit Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Epoksidit Wikimedia Commonsissa