Sykloheksaani
| Sykloheksaani | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| IUPAC-nimi | Sykloheksaani |
| PubChem CID | |
| SMILES | C1CCCCC1 |
| Ominaisuudet | |
| Molekyylikaava | C6H12 |
| Moolimassa | 84.16 g/mol |
| Ulkomuoto | neste[1] |
| Sulamispiste | 6.7 °C (279,85 K)[1] |
| Kiehumispiste | 80,7 °C (353.85 K)[1] |
| Tiheys | 0,7739 g/cm3 (25 °C)[1] |
| Liukoisuus veteen | liukenematon veteen; liukenee etanoliin, dietyylieetteriin, asetoniin, bentseeniin ja ligroiiniin[1] |
Sykloheksaani on kuuden hiiliatomin muodostama rengasrakenteinen sykloalkaani, josta käytetään myös nimiä heksahydrobentseeni ja heksametyleeni.
25 °C ja 1 atm oloissa sykloheksaanin taitekerroin on 1.4235, leimahduspiste –20 °C, itsesyttymislämpötila 245 °C ja liukoisuus veteen 0.058 g per kg H2O.[1]
Stereokemia[muokkaa | muokkaa wikitekstiä]
Aksiaalisuus ja ekvatoriaalisuus[muokkaa | muokkaa wikitekstiä]
Jokaisesta tuolimuotoisen sykloheksaanin konformaation hiiliatomista lähtee kaksi sidosta vetyatomeihin. Nämä jaetaan aksiaalisiin (pystyakselin suuntaisiin) ja ekvatoriaalisiin (vaakatasoisiin) sidoksiin. Nimet pätevät myös muihin sykloheksaaniin liittyneihin atomeihin/atomiryhmiin eli substituentteihin.[3]

Sykloheksaanin tuolikonformaatiossa C-H – sidokset ovat joko renkaan tasoa vasten kohtisuorassa (aksiaalisia) tai tason suunnassa (ekvatoriaalisia). Kuudesta aksiaalisesta sidoksesta kolme suuntautuu ylöspäin ja kolme alaspäin. Vastaavasti ekvatoriaaliset sidokset suuntautuvat alaspäin olevasta kulmasta viistosti ylöspäin tai ylöspäin olevasta kulmasta viistosti alaspäin.

Rengaskäännös ja konformaatiot[muokkaa | muokkaa wikitekstiä]
Yleisin konformaatio sykloheksaanilla on tuoli. Se voi läpikäydä rengaskäännöksen, jossa sykloheksaanin aksiaaliset sidokset muuttuvat ekvatoriaalisiksi ja päinvastoin (kuva alla). Käännös on tasapainoreaktio, joka se esitetään kaksoisnuolin (⇌).[3]

Rengaskäännös voi tapahtua hyvin ilman venemuotoa, mutta muut konformaatiot ovat täysin välttämättömiä.[4]
Rengasjännitys[muokkaa | muokkaa wikitekstiä]
Sykloheksaanin hiiliatomit ovat sp3 hybridisoituneet. Siksi ne pyrkivät tetraedrimuotoon, jossa kaikki atomien väliset sidoskulmat ovat noin 109.5° – kulmasta poikkeaminen aiheuttaa rengasjännitystä. Tuoli on sykloheksaanin vakain konformaatio ja sen hiilet ovat teoriassa tetraedrisiä eikä renkaassa ole rengasjännitystä. Todellisuudessa rengasjännitystä on hieman koska tuoli on litistynyt ihannekulmatilanteesta ja hiilten väliset sidoskulmat ovat noin 111.5°. Litistyminen johtuu siitä, että isot hiilet vievät toisiltaan (steerisesti) enemmän tilaa kuin pienet vedyt – vastaavasti hiili-vety ja vety-vety sidoskulmat ovat pienempiä. Rakenne pyrkii tilanteeseen, jossa steeristen vaikutusten ja rengasjännityksen yhteisvaikutus on pienin ja rakenne on mahdollisimman pienienerginen (katso Konformaatio#Rengasjännitys).[4] Rengaskäännökseen tarvittava energia on pieni, 43 kilojoulea per mooli (kJ/mol), joten sitä tapahtuu jatkuvasti ja nopeasti jo huoneenlämpötilassa.[3]
Konformeerit[muokkaa | muokkaa wikitekstiä]

Sykloheksaanin konformaatioista vakaimmat ovat diastereomeereihin kuuluvia konformeerejä,[5] jotka ovat tuoli ja kierrevene (kuvaaja alla).[3] Kierrevene voidaan myös luokitella rengaskäännöksen välimuodoksi. Vene ja puolituoli ovat siirtymätiloja.


Veneellä ei juuri ole rengasjännitystä, mutta sillä on rakenteen päiden aiheuttamaa steeristä jännitystä ja erityisesti "torsionaalista jännitystä",[4] joka johtuu hyperkonjugaation vähäisyydestä suhteessa matalaenergisempiin muotoihin (katso Konformaatio#Renkaiden hyperkonjugaatio ja muut vaikutukset).[6] Siksi vene on epävakaampi kuin tuoli. Kuten kuvaajasta yllä näkyy, puolituolin kokonaisenergia suurin kaikista sykloheksaanin konformaatioista ja siksi se on vähiten suotuisa. Vääntynyt vene on hieman venekonformaatiota vakaampi.[3]
Substituointi[muokkaa | muokkaa wikitekstiä]
Yksi- eli monosubstituenttisen sykloheksaanin substituentin eli siihen liittyneen atomin/atomiryhmän (jokin muu kuin vety) ollessa aksiaalisesti, hylkivät substituoidun sykloheksaanin aksiaaliset vetyatomit liittynyttä substituenttia – siksi monosubstitituoitu sykloheksaani on lähinnä konformaatiossa, jossa substituentti on ekvatoriaalisesti.[3]
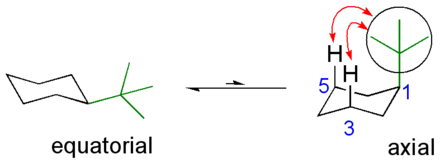
Rengaskäännösilmiön painottuneisuus substituentin ekvatoriaaliseen muotoon riippuu erityisesti substituentin koosta, mutta myös muista ominaisuuksista. Metyylisykloheksaanissa energiaero aksiaalisen ja ekvatoriaalisen muodon välillä on 7.3 kJ/mol, ja aksiaalinen muoto on 19 kertaa yleisempi kuin ekvatoriaalinen. tert-Butyylisykloheksaanissa ero on jo yli 20 kJ/mol ja ekvatoriaalinen on yli 3 000 kertaa yleisempi.[3] Alla on tert-butyylisykloheksaanin rakenne. Vedyt hiilissä 5 ja 3 hylkivät tert-butyyliryhmää (vihreä, ympyröity), ja tasapaino on voimakkaasti ekvatoriaalisen muodon suuntaan:
Edeltävän kaltaisen ekvatoriaalisuotuisuuden vuoksi monosubstituenttisen tuolimuotoisen sykloheksaanin substituentti merkitään yleisesti ekvatoriaaliseksi ja jos substituentteja on monta, on vakain muoto se, jossa suurin substituentti on ekvatoriaalinen.[7]
Valmistus[muokkaa | muokkaa wikitekstiä]
Sykloheksaania valmistetaan pääasiallisesti vedyttämällä bentseeniä. Tämä reaktio tapahtuu joko kaasu- tai nestefaasissa ja tyypillisiä katalyyttejä ovat nikkeli, platina ja palladium. Raaka-aineesta on poistettava hiilimonoksidi ja vetysulfidi, sillä nämä ovat katalyyttimyrkkyjä prosessissa.[8][9][10] Sykloheksaania esiintyy myös maaöljyssä[8], jossa sen pitoisuus vaihtelee. Korkeita sykloheksaanipitoisuuksia esiintyy muun muassa nigerialaisessa ja venezuelalaisella öljyssä, kun taas sitä on vähän Lähi-idän öljyesiintymissä.[9]
Suurin osa tuotetusta sykloheksaanista hapetetaan koboltti- tai boorihappokatalyyttien avulla sykloheksanoliksi tai sykloheksanoniksi, joita käytetään edelleen adipiinihapon ja kaprolaktaamin valmistukseen. Sykloheksaania voidaan lisätä myös polttoaineeseen tai käyttää eteenin valmistukseen tai laimentimena polymeerisynteeseissä. Sykloheksaanin liuotinominaisuudet ovat hyvät ja bentseenin kaltaiset, mutta se ei ole yhtä myrkyllistä kuin bentseeni. Liuottimena sitä usein käytetään seoksena muiden hiilivetyjen kanssa.[8][9][10]
Katso myös[muokkaa | muokkaa wikitekstiä]
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b c d e f WM Haynes & DR Lide & TJ Bruno: CRC Handbook of Chemistry and Physics, s. 3–132, 5–163, 16–25. 95. painos. Boca Raton, Florida: CRC Press, 2014. OCLC: 908078665. ISBN 9781482208689. Teoksen verkkoversio.
- ↑ Cyclohexane (Sykloheksaani) Käyttöturvallisuustiedote. 23.1.2020. Sigma Aldrich/Merck. Viitattu 16.9.2020.
- ↑ a b c d e f g h i J Clayden, N Greeves, S Warren: Organic chemistry, s. 367–368, 372–376. 2. painos. Oxford: University Press, 2001. OCLC: 867050415. ISBN 9780199270293.
- ↑ a b c V Dragojlovic: Conformational analysis of cycloalkanes. ChemTexts, 12.8.2015, 1. vsk, nro 3. doi:10.1007/s40828-015-0014-0. ISSN 2199-3793. Artikkelin verkkoversio.
- ↑ a b GP Moss: Basic terminology of stereochemistry (IUPAC Recommendations 1996). Pure and Applied Chemistry, 1.1.1996, 68. vsk, nro 12, s. 2193–2222. doi:10.1351/pac199668122193. ISSN 1365-3075. Artikkelin verkkoversio.
- ↑ J McMurry: Organic chemistry, s. 95, 119–120. Brooks/Cole, 2008. OCLC: 701208906. LCCN: 2010936830. ISBN 9780840054449.
- ↑ Jonathan Clayden, Nick Greevs, Stuart Warren, Peter Wothers: Organic Chemistry, s. 464. Oxford University Press, 2008. ISBN 9780198503460.
- ↑ a b c Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 31. Helsinki: Consalen Consulting, 2009. ISBN 9789529256273.
- ↑ a b c David E. Mears & Alan D. Eastman: Hydrocarbons, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2005. Viitattu 06.08.2013
- ↑ a b M. Larry Campbell: Cyclohexane, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2011. Viitattu 07.08.2013
Aiheesta muualla[muokkaa | muokkaa wikitekstiä]
- Sykloheksaanin kansainvälinen kemikaalikortti
- PubChem: Cyclohexane (englanniksi)
- Human Metabolome Database (HMDB): Cyclohexane (englanniksi)
- DrugBank: Cyclohexanes
- Kyoto Encyclopedia of Genes and Genomes (KEGG): Cyclohexane (englanniksi)
- ChemBlink: Cyclohexane (englanniksi)