Kiraalisuus
Kiraalisuus (kreik. χειρ 'käsi') eli kätisyys on stereokemiassa kaikkien epäsymmetristen molekyylien ominaisuus, joka ilmenee siten, että keskenään kiraaliset molekyylit ovat toistensa peilikuvia kuten oikea ja vasen käsi keskenään. Kiraalisten molekyylien peilikuvia ei voi niitä kääntelemällä asettaa rakenteellisesti täysin päällekkäin siten, että samanlaiset atomit ovat samassa kohtaa vastaavasti kuin avointa oikeaa ja vasenta kättä ei voi kääntelemällä asettaa rinnakkain siten että molemmissa peukalot, muut sormet ja kämmenselät ovat yhtä aikaa samoihin suuntiin.[1] Laajemmassa merkityksessään kiraalisuus onkin käsien ja kaikkien muiden epäsymmetristen kappaleiden ominaisuus.[2]

Kiraalinen molekyyli ja sen peilikuva ovat aina enantiomeerejä. Molekyyli on ei-kiraalinen eli akiraalinen, jos se on peilikuvansa kanssa identtinen. Molekyylin epäsymmetrisyys ja siten myös kiraalisuus johtuvat tavasta, jolla atomit ovat molekyylissä sitoutuneet eli molekyylin konfiguraatiosta. Pienin kiraalinen molekyyli koostuu neljä erilaista atomia sitovasta atomista. Tällaisessa molekyylissä ja muissa molekyyleissä tätä keskusatomia kutsutaan kiraliakeskukseksi.[2]
Molekyyleillä voi olla kiraalisia konformaatioita, mutta jos nämä voivat helposti muuntua yhdeksikin akiraaliseksi konformaatioksi, luokitellaan koko molekyyli akiraalikseksi riippumatta sen mahdollisista konformaatioista.[3] Esimerkiksi sykloheksaanin vääntynyt vene ‑konformaatio on itsessään kiraalinen, mutta se muuntuu helposti akiraaliseksi tuolikonformaatioksi. Siten sykloheksaani on akiraalinen. Proteiinien konformaatiot taas ovat verrattain pysyviä, joten niitä voidaan kutsua kiraalisiksi.
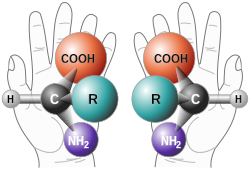
Koska hiiliatomi voi muodostaa neljä sidosta, monet hiiliyhdisteet ovat kiraalisia. Tunnetuimpia lienevät aminohapot. Ne voivat olla joko "vasen"- (lat. levo 'vasen') tai "oikeakätisiä" (lat. dextro 'oikea') eli L- tai D-muotoisia, mutta ovat luonnossa yleensä vain L-muodossa. Siksi luonnon aminohappojen voidaan sanoa olevan homokiraalisia.[1]
Useimmilla kiraalisilla molekyyleillä on yksi tai useampi kiraliakeskus, mutta joillain ei ole yhtäkään, kuten BINAP:llä ja joillain alleeneilla.[1] Näillä yhdisteillä on kuitenkin akseli, jonka suhteen ryhmät sijoittuvat epäsymmetriseksi. Tätä ilmiötä kutsutaan aksiaaliseksi kiraalisuudeksi.[2] Jotkin useita kiraliakeskuksia sisältävät molekyylit ovat vaihtoehtoisten "isomeeriensä" kanssa täysin identtisiä ja siten akiraalisia. Sellaiset ovat mesoyhdisteitä.[1]
Molekyylin kiraalisuutta pyritään usein määrittämään löytämällä molekyylistä symmetriatasoja tai ‑pisteitä. Jos näitä löytyy, on molekyyli akiraalinen.
Etymologia
[muokkaa | muokkaa wikitekstiä]Termit kiraalinen ja kiraalisuus keksi lordi Kelvin. Sanat on johdettu kreikankielen sanasta χειρ (’käsi’).[4] Termit julkaistiin 1904 Baltimore Lectures ‑kirjassa,[5][4] jonka julkaisun jälkeen termien käyttö alkoi saavuttaa laajempaa käyttöä.[6] Kirja kuitenkin pohjautuu Kelvinin vuosina 1884–1893 Baltimoren yliopistossa pitämiin luentoihin, joissa sanaa kiraalinen käytettiin suullisesti ensimmäisen kerran vuonna 1893. Varhaisin säilynyt kirjallinen todiste sanan käytöstä on vuodelta 1894 kirjassa Molecular Tactics of a Crystal,[4] jossa Kelvin kuvaa käsitettä seuraavanlaisesti:
»I call any geometrical figure, or group of points, 'chiral', and say that it has chirality if its image in a plane mirror, ideally realized, cannot be brought to coincide with itself.[7]»
Kuitenkin jo vuosina 1872–1873 Kelvin julkaisi paperin otsikolla Note on Homocheiral and Heterocheiral Similarity,[8]. Tiettävästi vain julkaisun otsikko on säilynyt, mutta sisällön oletetaan kadonneen.[4]
Optinen aktiivisuus
[muokkaa | muokkaa wikitekstiä]
Kiraaliset molekyylit ovat optisesti aktiivisia. Tämä tarkoittaa, että lisättäessä vain toista enantiomeereistä liuokseen ja valaistaessa tätä liuosta tasopolarisoidulla valolla, kääntää liuoksen enantiomeeri tätä liuoksen halki etenevää valoa valonlähdettä kohti katsovan näkökulmasta joko myötäpäivään ((+)-muoto) tai vastapäivään ((−)-muoto). Toinen enantiomeereistä taas kiertää valoa yhtä voimakkaasti, mutta vastakkaiseen suuntaan.[1] Tätä kullekin molekyylille ominaista kiertymisen voimakkuutta kuvataan ominaiskiertokyvyksi kutsuttavalla arvolla.[9]
Raseemisessa seoksessa on suunnilleen yhtä paljon molempia enantiomeerejä. Raseemisen seoksen molemmat enantiomeerit kääntävät tasopolarisoitua valoa eri suuntiin kumoten toistensa vaikutuksen. Siten raseeminen seos ei kierrä valoa eikä ole optisesti aktiivinen.[2]
Enantiopuhtaassa seoksessa on vain yhtä enantiomeeriä. Tällaista seosta kutsutaan joskus homokiraaliseksi, mutta IUPAC ei suosittele sanan käyttöä tässä merkityksessä. Enantiorikastuneessa seoksessa jompaakumpaa enantiomeeriä on enemmän, mutta molempia enantiomeerejä esiintyy.[2]
Kaikki kiraaliset molekyylit eivät kuitenkaan kierrä valoa kyllin voimakkaasti, jotta niiden ominaiskiertokyky voitaisiin mitata. Näitä molekyylejä kutsutaan joskus kryptokiraalisiksi. Kryptokiraalisuus on kiraalisuuden erityistapaus.[10]
Stereoisomeerien lukumäärä
[muokkaa | muokkaa wikitekstiä]Yhdisteellä, jolla on n kiraliakeskusta, on teoriassa enintään 2n mahdollista stereoisomeeriä, joiksi luetaan diastereomeerit ja enantiomeerit. Tosin myös E/Z-isomeerit luetaan stereoisomeereihin, mutta näitä ei ole, jos molekyylissä ei ole kaksoissidoksia. Jos molekyylillä on kaksi kiraliakeskusta, sillä voi olla 22 = 4 stereoisomeeriä. Tämä yksinkertaistus ei kuitenkaan aina pidä paikkaansa, sillä jonkin molekyylin symmetria voi aiheuttaa sen, että molekyylin stereoisomeereihin kuuluu mesoyhdisteitä. Nämä vähentävät todellisten stereoisomeerien lukumäärää. Tilanne on tämä esimerkiksi viinihapon kohdalla, jolla on kaksi kiraliakeskusta, ja siten teoriassa 4 stereoisomeeriä, mutta todellisuudessa stereoisomeerejä on 3.[1]
Merkitys
[muokkaa | muokkaa wikitekstiä]Aminohapot
[muokkaa | muokkaa wikitekstiä]
Eliöiden proteiineissa tavallisesti esiintyvistä 20 aminohaposta 19 on kiraalisia. Poikkeuksena on akiraalinen glysiini, jonka sivuketjuna on vetyatomi, minkä takia se ei voi peilautua erilaiseksi. Loput luonnon 19 aminohaposta esiintyvät luonnossa pelkästään L-muodossa eli ilmentävät homokiraalisuutta, vaikka niillä voi teoriassa olla L- ja D-muoto. Tämä pätee suhteellista konfiguraatiota kuvaavassa L/D-järjestelmässä.[11][12] Absoluuttista konfiguraatiota kuvaavassa R/S-järjestelmässä kiraaliset aminohapot ovat R-muotoa; poikkeuksena on kysteiini, joka on S-muotoa. Yleiset kiraaliset aminohapot ovat siten L ja R, mutta kysteiini on hieman absurdisti L ja S.[11][13]
Ei tiedetä, miksi proteiinien aminohapot ovat lähinnä L-muodossa esimerkiksi gramisidiinien kaltaisia poikkeuksia lukuun ottamatta[14], vaikka eliöiden ulkopuolella tapahtuvat abioottiset kemialliset reaktiot kuten Ureyn–Millerin koe tuottavat näiden muotojen yhtäläisiä seoksia eli rasemaatteja.[11] Aminohappojen homokiraalisuudesta aiheutuu myös proteiinien homokiraalisuus. Aminohappojen homokiraalisuuden seurauksena esimerkiksi proteiinien rakenteiden hyvin yleiset α-kierteet kiertyvät usein vain oikeakätisesti. Hyvin harvinaisia vasenkätisiä α-kierteitäkin on, mutta näitä muodostavat D-aminohapot, ja kierteet ovat vain 3–4 aminohappoa pitkiä.[15] Proteiinien homokiraalisuuden seurauksena eliöiden rakenteiden lisäksi myös aineenvaihdunta on pitkälti homokiraalista, sillä tätä suorittavat ja säätelevät entsyymit ja reseptorit ovat proteiineja. Tämä vaikuttaa esimerkiksi kiraalisten lääkkeiden toimintaan (tästä lisää alla).[16]
Periaatteessa elämä olisi voinut myös kehittyä sellaiseen muotoon, jossa olisi vain L- ja vain D-aminohapoista koostuvia proteiineja yhtä aikaa läsnä eliön rakenteissa. Tämä aiheuttaisi kuitenkin ongelmia esimerkiksi RNA:n synteesissä, joka on elämälle välttämätön tapahtuma (katso proteiinisynteesi). RNA:n valmistuessa tietyistä nukleiinihappojen enantiomeereistä, voi ketjuun liittyä vahingossa vastakkaisia enantiomeerejä, jotka pysäyttävät RNA-synteesin ennenaikaisesti.[17]
Sokerit
[muokkaa | muokkaa wikitekstiä]Luonnon yleisimmät sokerit ovat D-konfiguraatiossa. L-sokereitakin tosin esiintyy. Eliöiden entsyymit ovat usein kehittyneet kykeneviksi käsittelemään vain D-sokereita niiden yleisyyden vuoksi.[11]
Lääkkeet
[muokkaa | muokkaa wikitekstiä]Lääkkeiden kiraalisuudella voi olla merkitystä, koska enantiomeereistä toinen voi olla lääkevaikutteinen (eutomeeri) ja toinen ei (distomeeri). Toinen enantiomeeri voi myös olla myrkyllinen.[16] Esimerkiksi ihmisillä etambutolin (S,S)-etambutoli toimii tuberkuloosilääkkeenä, mutta (R,R)-etambutoli aiheuttaa silmähermojen tuhoutumista ja siten jopa sokeutta. Siksi lääkevalmisteissa käytetään vain (S,S)-etambutolia, jonka käyttö voi tosin myös aiheuttaa näön heikkenemistä.[18] Lääkkeiden enantiomeerien usein eriävät vaikutukset johtuvat kehon rakenteiden kiraalisuudesta. Reseptorit, jollaisiin lääkkeet usein sitoutuvat lääkevaikutuksen aiheuttaen, ovat kiraalisia. Siten reseptorit voivat sitoa vain tietyn muotoisia molekyylejä, mutta näiden peilikuvat eivät sitoudu reseptoreihin kunnolla.[16]
Yksi usein ja harhaanjohtavasti käytetty esimerkki lääkkeen kiraalisuudesta on talidomidi. Teoriassa vain R(+)-talidomi-enantiomeeri ehkäisee ihmisillä raskauden aikaista pahoinvointia ja vain S(−)-talidomi aiheuttaa epämuodostumia (fokomeliaa) sikiölle eli toimii teratogeeninä. Käytännössä kuitenkin elimistö muuntaa helposti molempia enantiomeereistä toisikseen, joten vain R-muodonkin käyttö johtaa epämuodostumiin. R- ja S-muotojen lisäksi talidomidista voi muodostua kehossa muitakin kiraalisia ja akiraalisia kehon aineenvaihdunnan tuotteita, jotka voivat ehkä olla sikiölle haitallisia.[16] Samankaltaista enantiomeerien muuntumista toisikseen tapahtuu ihmisessä joillakin muillakin kiraalisilla lääkkeillä kuten ibuprofeenilla. Muutos voi myös vaihdella eliölajeittain kuten ketorolaakin kohdalla. Ihmisessä 0 % R(+)-ketorolaakista muuntuu S(−)-ketorolaakiksi ja 6 % S-muodosta R-muodoksi, kun esimerkiksi hiirillä suurin muutos voi olla jopa 71 % ja rotilla 12 %.[19]
Enantiomeerien lääkevaikutukset voivat myös olla keskenään täysin erilaiset: dekstrometorfaani (metorfaanin D-muoto) on yskänlääke ja dissosiatiivi, kun taas levometorfaani (L-muoto) on opioidi.[20]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f J Clayden: Organic chemistry, s. 386–389, 395–398. 1. painos. Oxford University Press, 2001. OCLC: 43338068. ISBN 9780198503460.
- ↑ a b c d e GP Moss: Basic terminology of stereochemistry (IUPAC Recommendations 1996). Pure and Applied Chemistry, 1.1.1996, 68. vsk, nro 12, s. 2193–2222. doi:10.1351/pac199668122193. ISSN 1365-3075. Artikkelin verkkoversio.
- ↑ Organic Chemistry: Stereochemistry: Other Forms of Stereoisomerism sparknotes.com. Arkistoitu 21.3.2018. Viitattu 16.9.2018.
- ↑ a b c d R Bentley: Chiral: a confusing etymology. Chirality, tammikuu 2010, 22. vsk, nro 1, s. 1–2. PubMed:19229956. doi:10.1002/chir.20699. ISSN 1520-636X. Artikkelin verkkoversio.
- ↑ WT Kelvin: Baltimore lectures on molecular dynamics and the wave theory of light. Lontoo: C. J. Clay and sons; Baltimore, Publication agency of the Johns Hopkins university, 1904. Teoksen verkkoversio.
- ↑ VI Sokolov: Chirality in the world of stereochemistry. Computers & Mathematics with Applications, 1.5.1986, 12B. vsk, nro 3-4, s. 547–563. doi:10.1016/0898-1221(86)90410-4. ISSN 0898-1221. Artikkelin verkkoversio.
- ↑ WT Kelvin: The molecular tactics of a crystal, s. 27. Oxford, Clarendon Press, 1894. LCCN: 12034810. Teoksen verkkoversio.
- ↑ W Thomson: Note on homocheiral and heterocheiral similarity. Proc R Soc Edinburgh, 1872–1873, 8. vsk, nro 70.
- ↑ WM Haynes & DR Lide & TJ Bruno: CRC Handbook of Chemistry and Physics, s. 2–65. 95. painos. Boca Raton, Florida: CRC Press, 2014. OCLC: 908078665. ISBN 9781482208689. Teoksen verkkoversio.
- ↑ T Kawasaki et al.: Chiral Discrimination of Cryptochiral Saturated Quaternary and Tertiary Hydrocarbons by Asymmetric Autocatalysis. Journal of the American Chemical Society, toukokuu 2006, 128. vsk, nro 18, s. 6032–6033. doi:10.1021/ja061429e. ISSN 0002-7863. Artikkelin verkkoversio.
- ↑ a b c d AS Burton, EL Berger: Insights into Abiotically-Generated Amino Acid Enantiomeric Excesses Found in Meteorites. Life, 12.5.2018, 8. vsk, nro 2. PubMed:29757224. doi:10.3390/life8020014. ISSN 2075-1729. Artikkelin verkkoversio.
- ↑ DL Nelson & MM Cox: Lehninger principles of biochemistry, s. 72–75, 123–124, 283-284. 5. painos. New York: W.H. Freeman, 2008. OCLC: 191854286. LCCN: 2007941224. ISBN 9780716771081. Teoksen verkkoversio.
- ↑ A2. Amino Acid Stereochemistry Biology LibreTexts. 21.6.2016. Viitattu 10.9.2018.
- ↑ V Nanda, A Andrianarijaona, C Narayanan: The role of protein homochirality in shaping the energy landscape of folding. Protein Science, elokuu 2007, 16. vsk, nro 8, s. 1667–1675. PubMed:17600146. doi:10.1110/ps.072867007. ISSN 0961-8368. Artikkelin verkkoversio.
- ↑ NE Shepherd, HN Hoang, G Abbenante, DP Fairlie: Left- and right-handed alpha-helical turns in homo- and hetero-chiral helical scaffolds. Journal of the American Chemical Society, 4.11.2009, 131. vsk, nro 43, s. 15877–15886. PubMed:19807085. doi:10.1021/ja9065283. ISSN 1520-5126. Artikkelin verkkoversio.
- ↑ a b c d LA Nguyen, H He, C Pham-Huy: Chiral Drugs: An Overview. IJBS, kesäkuu 2006, 2. vsk, nro 2, s. 85–100. PubMed:23674971. ISSN 1550-9702. Artikkelin verkkoversio.
- ↑ GF Joyce, AW Schwartz, SL Miller, LE Orgel: The case for an ancestral genetic system involving simple analogues of the nucleotides. Proceedings of the National Academy of Sciences of the United States of America, heinäkuu 1987, 84. vsk, nro 13, s. 4398–4402. PubMed:2440020. ISSN 0027-8424. Artikkelin verkkoversio.
- ↑ S Lim: Ethambutol-associated optic neuropathy. Annals of the Academy of Medicine, Singapore, huhtikuu 2006, 35. vsk, nro 4, s. 274–278. PubMed:16710500. ISSN 0304-4602. Artikkelin verkkoversio.
- ↑ SW Smith: Chiral Toxicology: It's the Same Thing…Only Different. Toxicological Sciences, 4.5.2009, 110. vsk, nro 1, s. 4–30. doi:10.1093/toxsci/kfp097. ISSN 1096-6080. Artikkelin verkkoversio.
- ↑ KA Linn, MT Long, PS Pagel: “Robo-Tripping”: Dextromethorphan Abuse and its Anesthetic Implications. Anesthesiology and Pain Medicine, 14.11.2014, 4. vsk, nro 5. PubMed:25793175. doi:10.5812/aapm.20990. ISSN 2228-7523. Artikkelin verkkoversio.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Stereokemian sanasto (Arkistoitu – Internet Archive) (englanniksi)
- Stereokemian harjoitustehtäviä (Arkistoitu – Internet Archive) (englanniksi)