Bariumhydroksidi
| Bariumhydroksidi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | Ba(OH)2 |
| Moolimassa |
171,34 g/mol (vedettömänä) 189,39 g/mol (monohydraatti) 315,46 g/mol (oktahydraatti) |
| Ulkomuoto | Valkoinen kiinteä aine |
| Sulamispiste |
78 °C (591 K) (monohydraatti) 300 °C (573 K) (monohydraatti) 407 °C (680 K) (vedettömänä) |
| Kiehumispiste | 780 °C (1053 K) |
| Tiheys |
3,743 g/cm3 (monohydraatti) 2,18 g/cm3 (oktahydraatti, 16 °C) |
| Liukoisuus veteen |
1,67 g/100 ml °C) (3,89 g/100 ml (20 °C) 20,94 g/100 ml (60 °C) 101,4 g/100 ml (100 °C) |
Bariumhydroksidi (Ba(OH)2) on vahvasti emäksinen, barium- ja hydroksidi-ionien muodostama ioniyhdiste. Kaupallisena tuotteena se esiintyy tavallisesti valkoisena monohydraattina.
Valmistus[muokkaa | muokkaa wikitekstiä]
Bariumhydroksidia voidaan valmistaa liuottamalla bariumoksidia (BaO) veteen, jolloin se reagoi seuraavasti:
- BaO + 9 H2O → Ba(OH)2·8H2O
Bariumhydroksidi kiteytyy oktahydraattina, mutta ilmassa lämmitettynä se muuttuu monohydraatiksi. Tyhjiössä 100 °C:n lämpötilassa monohydraatti muuttuu jälleen bariumoksidiksi.[1]
Käyttö[muokkaa | muokkaa wikitekstiä]
Bariumhydroksidia käytetään analyyttisessa kemiassa heikkojen happojen, varsinkin orgaanisten happojen titraukseen. Sen kirkas vesiliuos ei voi sisältää karbonaattia, toisin kuin natrium- tai kaliumhydroksidi, koska bariumkarbonaatti ei liukene veteen. Tämän vuoksi sellaisia indikaattoreja kuten fenoliftaleiinia tai tymoliftaleiinia, joiden väri muuttuu emäksisessä liuoksessa, voidaan käyttää ilman, että titrauksessa syntyy virheitä liuoksessa olevien karbonaatti-ionien vuoksi, jotka ovat paljon vähemmän emäksisiä.[2]
Bariumhydroksidia käytetään orgaanisissa synteeseissä vahvana emäksenä, esimerkiksi esterien[3] ja nitriilien hydrolyysissä[4].
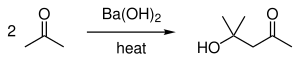
Sen avulla on myös voitu valmistaa synteettisesti esimerkiksi syklopentanonia[5], diasetonialkoholia[6] ja guloni-γ-laktonia.[7]
Bariumhydroksidin avulla voidaan havainnollistaa, mikä on endoterminen reaktio, sillä sekoitettaessa bariumhydroksidiin jotakin ammoniumsuolaa seos kylmenee, koska se absorboi lämpöä ympäristöstään.
Bariumhydroksidin avulla voidaan myös neutraloida roiskuneet happopisarat.
Reaktiot[muokkaa | muokkaa wikitekstiä]
Kuumennettaessa 800 °C:n lämpötilaan bariumhydroksidi hajoaa bariumoksidiksi. Reagoidessaan hiilidioksidin kanssa se muodostaa bariumkarbonaattia. Bariumhydroksidin vesiliuos, joka on vahvasti emäksinen, reagoi happojen kanssa neutraloiden ne. Esimerkiksi rikkihapon kanssa se muodostaa bariumsulfaattia, fosforihapon kanssa bariumfosfaattia. Rikkivedyn kanssa se muodostaa bariumsulfidia. Sekoitettuna monien metallien suolaliuosten kanssa se saattaa muodostaa niukkaliukoisia tai liukenemattomia saostumia.[8]
Vaarat[muokkaa | muokkaa wikitekstiä]
Bariumhydroksidi on vaarallista samasta syystä kuin muutkin vahvat emäkset ja vesiliukoiset bariumyhdisteet. Se on myrkyllistä ja syövyttävää.
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ Gmelins Handbuch der anorganischen Chemie (8. Aufl.), s. 289. Weinheim: Verlag Chemie, 1960. (saksaksi)
- ↑ J. Mendham, R. C. Denney, J. D. Barnes & M. J. K Thomas: Vogel's Quantitative Chemical Analysis (6th ed.). New York: Prentice Hall, 2000. ISBN 0-582-22628-7.
- ↑ K. Meyer & H. S. Bloch: Organic Syntheses: Napthoresercinol orgsyn.org. Viitattu 4.3.2013. (englanniksi)
- ↑ C. G. Brown: Organic Syntheses: Methylsuccinic acid orgsyn.org. Viitattu 4.3.2013. (englanniksi)
- ↑ J. F. Thorpe & G. A. R Kon: Organic Syntheses: Cyclopentanone orgsyn.org. Viitattu 4.3.2013.
- ↑ J. B. Conant & Niel Tuttle: Organic Syntheses: Diacetone alcohol orgsyn.org. Viitattu 4.3.2013.
- ↑ J. V. Karabinos: D-Gulonic γ-lactone Organic Syntheses: Gulonic γ-lactone orgsyn.org. Viitattu 4.3.2013.
- ↑ Pradyot Patnaic: Handbook of Inorganic Chemicals. McGraw-Hill, 2002. ISBN 0-07-049439-8.
Aiheesta muualla[muokkaa | muokkaa wikitekstiä]
- PubChem: Barium hydroxide (englanniksi)
- ChemBlink: Barium hydroxide (englanniksi)
- ChemBlink: Barium hydroxide monohydrate (englanniksi)
- ChemBlink: Barium hydroxide octahydrate (englanniksi)