Ero sivun ”Booritrioksidi” versioiden välillä
| [katsottu versio] | [katsottu versio] |
p r2.7.1) (Botti lisäsi: fa:برون تری اکسید |
p r2.7.2) (Botti muokkasi: pl:Tritlenek diboru |
||
| Rivi 48: | Rivi 48: | ||
[[nl:Boortrioxide]] |
[[nl:Boortrioxide]] |
||
[[ja:酸化ホウ素]] |
[[ja:酸化ホウ素]] |
||
[[pl: |
[[pl:Tritlenek diboru]] |
||
[[pt:Trióxido de boro]] |
[[pt:Trióxido de boro]] |
||
[[ru:Оксид бора]] |
[[ru:Оксид бора]] |
||
Versio 25. kesäkuuta 2012 kello 22.27
| Booritrioksidi | |
|---|---|
[[Tiedosto: 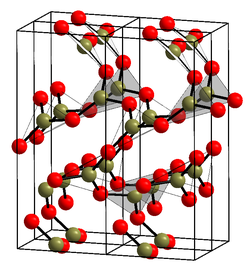 |275px|]] |275px|]] |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | B2O3 |
| Moolimassa | 69,62 g/mol |
| Ulkomuoto | Lasimaista massaa tai valkoista kiteistä jauhetta |
| Sulamispiste | 450°C[1] |
| Kiehumispiste | 1860°C[2] |
| Tiheys |
2,46 g/cm3 (kiteinen muoto) 1,8 g/cm3 (amorfinen muoto) [2] |
| Liukoisuus veteen | Reagoi veden kanssa [1] |
Booritrioksidi (B2O3) on boorin ja hapen muodostama epäorgaaninen yhdiste. Aine on boorihapon anhydridi. Yhdistettä käytetään muun muassa lasin valmistuksessa.
Ominaisuudet
Booritrioksidia esiintyy kahtena muotona: amorfisena, lasimaisena aineena, joka imee itseensä ilman kosteutta sekä rombisesti kiteytyvänä kiinteänä aineena. Veden kanssa reagoidessaan booritrioksidi muodostaa boorihappoa, ja syövyttää tämän vuoksi metalleja. Liukenemisessa vapautuu suuri määrä lämpöä eli reaktio on eksoterminen.[1][2][3]
- B2O3 + 3 H2O → 2 H3BO3
Sulana booritrioksidi kykenee liuottamaan monien metallien oksideja. Tällöin syntyy värillisiä yhdisteitä, joita voidaan käyttää hyödyksi kvalitatiivisessa analyysissä.[1]
Valmistus
Booritrioksidia valmistetaan hehkuttamalla boorihappoa, jolloin happomolekyylistä poistuu vety. Kuumennettaessa syntyy ensin metaboorihappoa ja edelleen kuumennettaessa booritrioksidia.[1]
- 2 H3BO3 → 2 HBO2 + 2 H2O
- 2 HBO2 → B2O3 + H2O
Käyttö
Booritrioksidia käytetään enimmäkseen lasin ja emalin valmistukseen.[3] Yleensä booritrioksidia lisätään piidioksidin joukkoon, jolloin saadaan borosilikaattilasia, mutta pelkästä booritrioksidistakin voidaan valmistaa boraattilasia, jolla on voimakas taittokyky ja valon dispersio on vähäistä. Boraattilasiin lisätään usein alkalimetallien oksideita tai lantaanioksidia.[4]
Booritrioksidia käytetään myös muiden booriyhdisteiden, kuten boorikarbidin ja booritrifluoridin, valmistukseen ja niin kutsuttuna fluksina metallurgiassa.[3]
Myrkyllisyys
Booritrioksidi on ärsyttävä yhdiste ja aiheuttaa hengitettäessä yskimistä ja kurkkukipua. Silmiin joutuessaan aiheuttaa punoitusta ja kipua. Nieltynä booritrioksidi aiheuttaa huonovointisuutta.[2]
Lähteet
- ↑ a b c d e E.M.Karamäki: Epäorgaaniset kemikaalit, s. 116. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3.
- ↑ a b c d Boorioksidi Kansainväliset kemikaalikortit. 1996. ICSC. Viitattu 3.1.2010.
- ↑ a b c Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 146. Walter de Gruyter, 1994. ISBN 978-3110114515. Kirja Googlen teoshaussa (viitattu 3.1.2010). (englanniksi)
- ↑ David E. Clark,Bruce K. Zoitos: Corrosion of glass, ceramics, and ceramic superconductors, s. 288. William Andrew, 1992. ISBN 978-0-8155-1283-7. Kirja Googlen teoshaussa (viitattu 3.1.2010). (englanniksi)