Ero sivun ”Litiumnitraatti” versioiden välillä
| [katsottu versio] | [katsottu versio] |
liimablankkoja |
varoitusmerkit |
||
| Rivi 11: | Rivi 11: | ||
| tiheys = 2,37 g/cm<sup>3</sup><ref name ="ullmann">Ulrich Wietelmann & Martin Steinbild: ''Lithium and Lithium Compounds, Ullmann's Encyclopedia of Industrial Chemistry'', John Wiley & Sons, New York, 2014. Viitattu 2.6.2016</ref> |
| tiheys = 2,37 g/cm<sup>3</sup><ref name ="ullmann">Ulrich Wietelmann & Martin Steinbild: ''Lithium and Lithium Compounds, Ullmann's Encyclopedia of Industrial Chemistry'', John Wiley & Sons, New York, 2014. Viitattu 2.6.2016</ref> |
||
| liukoisuus = 1020 g/l (25 °C)<ref name ="crc">{{Kirjaviite | Tekijä =William M. Haynes, David R. Lide, Thomas J. Bruno | Nimeke =CRC Handbook of Chemistry and Physics | Vuosi =2012 | Sivu =4–72 | Selite =39th Edition | Julkaisija =CRC Press | Tunniste =ISBN 978-1439880494 | www =http://books.google.fi/books?id=-BzP7Rkl7WkC&pg=RA4-PA72&dq=Lithium+nitrate&hl=fi&sa=X&ei=1a0HUpKgL6S44ATSiYGIDw&ved=0CC8Q6AEwADgK#v=onepage&q=Lithium%20nitrate&f=false | www-teksti =Kirja Googlen teoshaussa | Viitattu =2.6.2016 | Kieli ={{en}}}}</ref> |
| liukoisuus = 1020 g/l (25 °C)<ref name ="crc">{{Kirjaviite | Tekijä =William M. Haynes, David R. Lide, Thomas J. Bruno | Nimeke =CRC Handbook of Chemistry and Physics | Vuosi =2012 | Sivu =4–72 | Selite =39th Edition | Julkaisija =CRC Press | Tunniste =ISBN 978-1439880494 | www =http://books.google.fi/books?id=-BzP7Rkl7WkC&pg=RA4-PA72&dq=Lithium+nitrate&hl=fi&sa=X&ei=1a0HUpKgL6S44ATSiYGIDw&ved=0CC8Q6AEwADgK#v=onepage&q=Lithium%20nitrate&f=false | www-teksti =Kirja Googlen teoshaussa | Viitattu =2.6.2016 | Kieli ={{en}}}}</ref> |
||
| varoitusmerkit = [[Image:GHS-pictogram-exclam.svg|40px]] [[Image:GHS-pictogram-rondflam.svg|40px]] <ref>{{Verkkoviite | Osoite = https://pubchem.ncbi.nlm.nih.gov/compound/Lithium-nitrate | Nimeke = Lithium nitrate | Tekijä = | Tiedostomuoto = | Selite = | Julkaisu = PubChem | Ajankohta = | Julkaisupaikka = | Julkaisija = | Viitattu = 8.9.2024 | Kieli = {{en}} }}</ref> |
|||
}} |
}} |
||
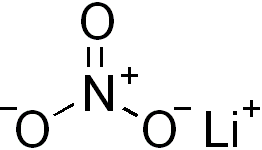
'''Litiumnitraatti''' (LiNO<sub>3</sub>) on [[litium]]- ja [[nitraatti]]-ionien muodostama [[epäorgaaninen yhdiste|epäorgaaninen]] [[ioniyhdiste]]. Yhdistettä voidaan käyttää muun muassa pyrotekniikassa, suolasulana vulkanoinnissa ja orgaanisissa synteeseissä reagenssina. |
'''Litiumnitraatti''' (LiNO<sub>3</sub>) on [[litium]]- ja [[nitraatti]]-ionien muodostama [[epäorgaaninen yhdiste|epäorgaaninen]] [[ioniyhdiste]]. Yhdistettä voidaan käyttää muun muassa pyrotekniikassa, suolasulana vulkanoinnissa ja orgaanisissa synteeseissä reagenssina. |
||
Nykyinen versio 8. syyskuuta 2024 kello 21.56
| Litiumnitraatti | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | LiNO3 |
| Moolimassa | 68,951 |
| Ulkomuoto | Väritön kiteinen aine[1] |
| Sulamispiste | 251 °C[2] |
| Tiheys | 2,37 g/cm3[3] |
| Liukoisuus veteen | 1020 g/l (25 °C)[4] |
Litiumnitraatti (LiNO3) on litium- ja nitraatti-ionien muodostama epäorgaaninen ioniyhdiste. Yhdistettä voidaan käyttää muun muassa pyrotekniikassa, suolasulana vulkanoinnissa ja orgaanisissa synteeseissä reagenssina.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Huoneenlämpötilassa litiumnitraatti on väritöntä ja voimakkaasti hygroskooppista kiteistä ainetta. Se liukenee erittäin hyvin veteen ja liukenee myös eräisiin orgaanisiin liuottimiin kuten etanoliin. Muiden nitraattien tavoin yhdiste on voimakas hapetin. Kuumennettaessa litiumnitraattia se hajoaa litiumoksidiksi. Kidevedettömän yhdisteen lisäksi tunnetaan myös kidevedellinen trihydraatti (LiNO3·3H2O). Aine muodostaa useiden muiden ioniyhdisteiden kanssa matalan sulamispisteen omaavia eutektisia seoksia.[1][2][3][4][6]
Valmistus ja käyttö
[muokkaa | muokkaa wikitekstiä]Litiumnitraattia valmistetaan liuottamalla litiumoksidia, litiumhydroksidia tai litiumkarbonaattia typpihappoon.[1][2]
- Li2O + 2 HNO3 → 2 LiNO3 + H2O
- LiOH + HNO3 → LiNO3 + H2O
- Li2CO3 + 2 HNO3 → 2 LiNO3 + H2O + CO2
Litiumnitraattia voidaan käyttää pyrotekniikassa esimerkiksi iloitulitteissa yhdessä strontiumnitraatin kanssa punaisen värin aikaansaamiseksi. Sen ja muiden suolojen sulatteita käytetään kumien vulkanoinneissa.[1][2][3] Orgaanisessa kemiassa sitä voidaan käyttää yhdessä trifluorietikkahappoanhydridin kanssa valmistettaessa alkoholeista niiden nitraattiestereitä.[7] Litiumnitraattia voidaan lisätä sementin joukkoon estämään halkeamien syntymistä[8].
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 605. Walter de Gruyter, 1994. ISBN 978-3110114515 (englanniksi)
- ↑ a b c d Conrad W. Kamienski, Daniel P. McDonald, Marshall W. Stark & John R. Papcun: Lithium and Lithium Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2004. Viitattu 2.6.2015
- ↑ a b c Ulrich Wietelmann & Martin Steinbild: Lithium and Lithium Compounds, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2014. Viitattu 2.6.2016
- ↑ a b William M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics, s. 4–72. (39th Edition) CRC Press, 2012. ISBN 978-1439880494 Kirja Googlen teoshaussa (viitattu 2.6.2016). (englanniksi)
- ↑ Lithium nitrate PubChem. Viitattu 8.9.2024. (englanniksi)
- ↑ Michael Clugston,Rosalind Flemming: Advanced Chemistry, s. 292. Oxford University Press, 2008. ISBN 978-0199146338 Kirja Googlen teoshaussa (viitattu 2.6.2016). (englanniksi)
- ↑ Jai Prakash Agrawal,R. D. Hodgson: Organic chemistry of explosives, s. 96. John Wiley and Sons, 2007. ISBN 978-0-470-02967-1 Kirja Googlen teoshaussa (viitattu 2.6.2016). (englanniksi)
- ↑ Robert J. F. Goodfellow: Concrete for Underground Structures, s. 80. SME, 2011. ISBN 978-0873353465 Kirja Googlen teoshaussa (viitattu 2.6.2016). (englanniksi)