Ero sivun ”Vetyfluoridi” versioiden välillä
| [arvioimaton versio] | [arvioimaton versio] |
Ei muokkausyhteenvetoa |
Ei muokkausyhteenvetoa |
||
| Rivi 13: | Rivi 13: | ||
}} |
}} |
||
'''Vetyfluoridi''' eli '''fluorivety''' (HF) on [[Vety|vedyn]] ja [[fluori]]n muodostama [[molekyyli]]yhdiste. Muista [[Halidi|halideista]] poiketen vetyfluoridin kiehumispiste on hyvin lähellä huoneen lämpötilaa. Vetyfluoridin vesiliuosta kutsutaan [[Fluorivetyhappo|fluorivetyhapo]]ksi, joka on vain miedosti hapan , mutta vahvasti korrosoiva. Ainetta käytetään laajasti [[petrokemia]]nteollisuudessa ja on tärkeä yhdiste niin kutsuttujen |
'''Vetyfluoridi''' eli '''fluorivety''' (HF) on [[Vety|vedyn]] ja [[fluori]]n muodostama [[molekyyli]]yhdiste. Muista [[Halidi|halideista]] poiketen vetyfluoridin kiehumispiste on hyvin lähellä huoneen lämpötilaa. Vetyfluoridin vesiliuosta kutsutaan [[Fluorivetyhappo|fluorivetyhapo]]ksi, joka on vain miedosti hapan , mutta vahvasti korrosoiva. Ainetta käytetään laajasti [[petrokemia]]nteollisuudessa ja on tärkeä yhdiste niin kutsuttujen [[superhappo]]jen valmistuksessa. |
||
== Vetyfluoridin rakenne == |
== Vetyfluoridin rakenne == |
||
Versio 11. helmikuuta 2007 kello 16.41
| Vetyfluoridi | |
|---|---|
[[Tiedosto: |275px|]] |275px|]] |
|
| Tunnisteet | |
| Muut nimet | Fluorivety, Fluorivetyhappo |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | HF |
| Moolimassa | 20,008 g/mol |
| Ulkomuoto | Väritön neste tai kaasu |
| Sulamispiste | -84 °C (189,15 K) |
| Kiehumispiste | 19.54 °C (292,69 K) |
| Tiheys | 0.922 kg/m3 |
| Liukoisuus veteen | Erittäin hyvä |
Vetyfluoridi eli fluorivety (HF) on vedyn ja fluorin muodostama molekyyliyhdiste. Muista halideista poiketen vetyfluoridin kiehumispiste on hyvin lähellä huoneen lämpötilaa. Vetyfluoridin vesiliuosta kutsutaan fluorivetyhapoksi, joka on vain miedosti hapan , mutta vahvasti korrosoiva. Ainetta käytetään laajasti petrokemianteollisuudessa ja on tärkeä yhdiste niin kutsuttujen superhappojen valmistuksessa.
Vetyfluoridin rakenne
Vetyfluoridikiteet koostuvat siksakmaisista molekyyliketjuista. Molekyylien sisäiset kovalenttiset sidokset ovat noin 0,95 pikometriä pitkiä. Molekyylit ovat kiinni toisissaan sähköisellä vetovoimalla, vetysidoksilla. (Merkitty kuvaan katkoviivoilla.)
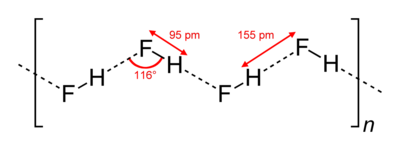
Myös nestemäisessä olomuodossa vetyfluoridimolekyylit muodostavat ketjuja, jotka tosin ovat lyhyempiä noin viiden tai kuuden molekyylin mittaisia. Vetyfluoridin korkeampi kiehumispiste muihin molekyylirakenteisiin halideihin verrattuna johtuu pitkälti vahvoista vetysidoksista.
Käyttö ja valmistus
Vetyfluoridia käytetään muun muassa polymeerien fluorauksessa, maaöljyn jalostuksessa, lasinvalmistuksessa ja etsauksessa, alumiinin tuotannossa ja uraaniheksafluoridin syntetisoinnissa.
Vetyfluoridia valmistetaan kalsiumfluoridista ja rikkihaposta.
- CaF2 + H2SO4 → CaSO4 + 2 HF
Ainetta myydään yleensä anhydridinä tai 70- ta 49-prosenttisina vesiliuoksina.
Terveysvaikutukset
Aine on myrkyllistä ja voi olla jopa kuolettavaa pieninäkin annoksina ravinnossa tai ihon läpi imeytyneenä. Iholle joutuessaan aine voi aiheuttaa vakaviakin vaurioita ja hengitettynä tai nieltynä aiheuttaa pahoinvointia. [1]