Ero sivun ”Resonanssi (kemia)” versioiden välillä
| [katsottu versio] | [katsottu versio] |
pEi muokkausyhteenvetoa |
Ei muokkausyhteenvetoa |
||
| Rivi 5: | Rivi 5: | ||
Kieli ={{en}} }}</ref> Yhdiste ei myöskään vaihtele resonanssimuodosta toiseen ja on vakaampi kuin mikään yksittäinen resonanssimuoto.<ref>{{Kirjaviite | Tekijä = John McMurry | Nimeke = Organic Chemistry (5th edition) | Vuosi = 2000| Kappale = | Sivu = 47| Selite = | |
Kieli ={{en}} }}</ref> Yhdiste ei myöskään vaihtele resonanssimuodosta toiseen ja on vakaampi kuin mikään yksittäinen resonanssimuoto.<ref>{{Kirjaviite | Tekijä = John McMurry | Nimeke = Organic Chemistry (5th edition) | Vuosi = 2000| Kappale = | Sivu = 47| Selite = | |
||
Julkaisupaikka = | Julkaisija =Brooks/Cole| Tunniste = ISBN 0-534-37366-6 | www = | www-teksti = | Tiedostomuoto = | Viitattu = | |
Julkaisupaikka = | Julkaisija =Brooks/Cole| Tunniste = ISBN 0-534-37366-6 | www = | www-teksti = | Tiedostomuoto = | Viitattu = | |
||
Kieli ={{en}} }}</ref> Yhdisteen todellinen rakenne on resonanssimuotojen yhdistelmä, resonanssihybridi, jolla on molempien resonanssimuotojen piirteitä.<ref name="Organic Chemistry s46" /> Atomien paikat tai [[hybridisaatio]]t eivät muutu resonanssirakenteissa. |
Kieli ={{en}} }}</ref> Yhdisteen todellinen rakenne on resonanssimuotojen yhdistelmä, resonanssihybridi, jolla on molempien resonanssimuotojen piirteitä.<ref name="Organic Chemistry s46" /> Atomien paikat tai [[hybridisaatio]]t eivät muutu resonanssirakenteissa. Käytännössä resonanssirakenteita käytetään usein kuvaamaan elektronien [[Kvanttimekaniikka|kvanttimekaanista]] [[Delokalisaatio|delokalisaatiota]], jossa elektronitiheys vaihtelee eri ääripäiden välillä. |
||
==Lähdeviitteet== |
==Lähdeviitteet== |
||
Versio 22. joulukuuta 2021 kello 21.09
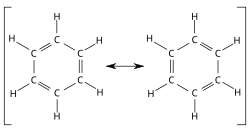
Resonanssilla tarkoitetaan Kékulen viivasidos- ja Lewisin rakennekaavoilla kuvattuja resonanssimuotoja, joissa sidosten ja vapaiden elektroniparien paikka vaihtelee. Rakenteiden väliin merkitään kaksipäinen nuoli <—> ja kaavat sijoitetaan hakasulkuihin. Resonanssimuodoissa eri paikoissa olevia elektroneja sanotaan delokalisoituneiksi. Yksittäiset resonanssimuodot eivät ole todellisia.[1] Yhdiste ei myöskään vaihtele resonanssimuodosta toiseen ja on vakaampi kuin mikään yksittäinen resonanssimuoto.[2] Yhdisteen todellinen rakenne on resonanssimuotojen yhdistelmä, resonanssihybridi, jolla on molempien resonanssimuotojen piirteitä.[1] Atomien paikat tai hybridisaatiot eivät muutu resonanssirakenteissa. Käytännössä resonanssirakenteita käytetään usein kuvaamaan elektronien kvanttimekaanista delokalisaatiota, jossa elektronitiheys vaihtelee eri ääripäiden välillä.
Lähdeviitteet
- ↑ a b John McMurry: Organic Chemistry (5th edition), s. 46. Brooks/Cole, 2000. ISBN 0-534-37366-6. (englanniksi)
- ↑ John McMurry: Organic Chemistry (5th edition), s. 47. Brooks/Cole, 2000. ISBN 0-534-37366-6. (englanniksi)