Triklabendatsoli
| |
Triklabendatsoli
| |
| Systemaattinen (IUPAC) nimi | |
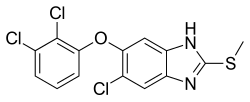
| 6-kloori-5-(2,3-dikloorifenoksi)-2-metyylisulfanyyli-1H-bentsimidatsoli | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | P02 |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C14H9N2Cl3OS |
| Moolimassa | 359,652 |
| SMILES | Etsi tietokannasta: , |
| Fysikaaliset tiedot | |
| Sulamispiste | 175–176 °C [1] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | ? |
| Proteiinisitoutuminen | 97 %[2] |
| Metabolia | Hepaattinen |
| Puoliintumisaika | 8 h[2] |
| Ekskreetio | ? |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
? |
| Reseptiluokitus |
|
| Antotapa | Oraalinen |
Triklabendatsoli (C14H9SN2Cl3O) on bentsimidatsolijohdannaisiin kuuluva heterosyklinen orgaaninen yhdiste. Yhdistettä käytetään lääketieteessä ja eläinlääketieteessä eräiden loismatoinfektioiden, erityisesti maksamatoinfektioiden, hoitamiseen. Triklabendatsoli kuuluu WHO:n julkaisemaan keskeisimpien lääkeaineiden luetteloon[3].
Ominaisuudet ja käyttö[muokkaa | muokkaa wikitekstiä]
Huoneenlämpötilassa triklabendatsoli on kiteistä ainetta. Yhdiste liukenee etanoliin, heksaaniin ja tetrahydrofuraaniin.[4] Triklabendatsoli on aktiivinen erityisesti tiehytmatoihin kuuluvaa lampaan maksamatoa (Fasciola hepatica) ja samaan sukuun kuuluvaa lajia Fasciola gigantica vastaan. Sen sijaan muihin matoihin sen teho on suhteellisen heikko. Sen on raportoitu tehoavan myös paragonimiaasia aiheuttavaan Paragonimus westermani -matoon. Triklabendatsoli sitoutuu loismatojen tubuliiniproteiiniin ja estää mikrotubuluksien muodostumisen. Tällöin matojen solunjakautuminen estyy ja madot kuolevat.[4][5][6]
Triklabendatsoli voi haittavaikutuksinaan aiheuttaa kuumetta, vilunväristyksiä, ylävatsakipuja ja leukopeniaa.[5]
Valmistus[muokkaa | muokkaa wikitekstiä]
Triklabendatsolin synteesin ensimmäisessä vaiheessa 1,2,4-triklooribentseeni nitrataan, ja tämän jälkeen se reagoi ammoniakin kanssa, jolloin 4-asemassa oleva klooriatomi korvautuu aminoryhmällä. Seuraava vaihe on reaktio 2,3-dikloorifenolin kanssa. Tämän jälkeen nitroryhmä pelkistetään, ja viimeiset vaiheet ovat reaktio hiilidisulfidin ja metyylijodidin kanssa.[4]
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ Susan Budavari (päätoim.): Merck Index, s. 1645. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- ↑ a b Triclabendazole DrugBank. Viitattu 22.3.2019. (englanniksi)
- ↑ WHO Model List of Essential Medicines 2015. WHO. Viitattu 22.3.2019. (englanniksi)
- ↑ a b c Achim Harder: Anthelmintics, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2009. Viitattu 22.3.2019
- ↑ a b J. K. Aronson (toim.): Meyler's Side Effects of Drugs, s. 142. Elsevier, 2015. ISBN 978-0-444-53717-1 (koko sarja). Kirja Googlen teoshaussa, 16th ed. 2016 (viitattu 22.3.2019). (englanniksi)
- ↑ Douglas L. Mayers, Stephen A. Lerner, Marc Ouellette, Jack D. Sobel: Antimicrobial Drug Resistance, s. 721. Springer, 2009. ISBN 978-1603275941. Kirja Googlen teoshaussa (ISBN 978-1-60327-592-7) (viitattu 22.3.2019). (englanniksi)