Boorinitridi
| Boorinitridi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | BN |
| Moolimassa | 24,82 |
| Ulkomuoto | Valkoinen kiteinen aine |
| Sulamispiste | 2967 °C[1] |
| Tiheys |
2,27 g/cm3 (heksagonaalinen) 3,48 g/cm3 (kuutiollinen)[2] |
| Liukoisuus veteen | Ei liukene veteen[1] |
Boorinitridi (BN) on boorin ja typen muodostama epäorgaaninen yhdiste. Yhdistettä käytetään muun muassa voiteluaineena ja hioma-aineena sekä korkean lämpötilan sovellutuksissa.
Ominaisuudet[muokkaa | muokkaa wikitekstiä]
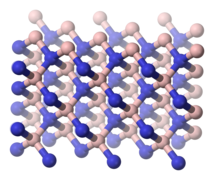
Huoneenlämpötilassa boorinitridi on valkoista kiteistä ainetta. Yhdiste on isoelektroninen hiilen kanssa ja sen polymorfit muistuttavat rakenteeltaan hiilen allotrooppeja. Heksagonaalinen boorinitridi muistuttaa grafiittia. Sen rakenteessa boori- ja typpiatomit muodostavat kerrosmaisen rakenteen ja kerroksissa boori- ja typpiatomit ovat järjestäytyneet kuusikulmioiksi. Grafiitin tavoin heksagonaalisessa boorinitridissä kerrokset voivat liukua toisiinsa nähden. Kuutiollisen boorinitridin rakenne on timantinkaltainen. Se on timanttia pehmeämpää, mutta kestää paremmin korkeita lämpötiloja ja kemikaaleja. Timantin tavoin kuutiollinen boorinitridi johtaa hyvin lämpöä, mutta huonosti sähköä. Kolmas boorinitridin polymorfi on rakenteeltaan heksagonaalista ja muistuttaa wurtsiittia ja lonsdaleiittia. Nämä kaksi yhdisteen polymorfia muuntuvat heksagonaaliseksi boorinitridiksi yli 1700 °C:n lämpötilassa.[2][3][4][5][6][7][8]
-
Heksagonaalisen boorinitridin rakenne
-
Kuutiollisen boorinitridin rakenne
-
Wurtsiittia muistuttavan boorinitridin rakenne
Kaikki boorinitridin polymorfit kestävät korkeita lämpötiloja eivätkä reagoi helposti. Aine ei liukene veteen eikä happoihin, mutta reagoi kuumien ja väkevien emästen kanssa. Boorinitridi ei reagoi halogeenien kanssa alle 700 °C:n lämpötilassa. Grafiitin tavoin heksagonaalisen boorinitridikerrosten väliin voi interkalatoitua muita atomeja, ioneja tai yhdisteitä.[2][3][4][5][6][8]
Valmistus ja käyttö[muokkaa | muokkaa wikitekstiä]
Boorinitridiä muodostuu kuumennettaessa booria typpi-ilmakehässä. Heksagonaalista boorinitridiä valmistetaan booritrioksidin ja ammoniakin tai urean reaktiolla. Toinen tapa on booritrikloridin ja ammoniakin reaktio. Muita boorinitridin polymorfeja valmistetaan heksagonaalisesta boorinitridistä korkeassa lämpötilassa ja paineessa. Esimerkiksi kuutiollista boorinitridiä saadaan 1 400–1 700 °C:n lämpötilassa ja 4–6 GPa:n paineessa. Katalyyttinä tässä faasimuutoksessa voidaan käyttää litiumnitridiä.[2][3][4][5][7][6][8]
- B2O3 + 2 NH3 → 2 BN + 3 H2O
- BCl3 + NH3 → BN + 3 HCl
Heksagonaalista boorinitridiä käytetään kiinteänä voiteluaineena, upokasten valmistamiseen, plasmakaariuunien ja rakettien seinämien vuorauksiin sekä useissa muissa erityisesti korkean lämpötilan sovellutuksissa. Siitä valmistetaan myös kestäviä kuituja. Kuutiollisen boorinitridin käyttökohteita ovat esimerkiksi hioma-aineet ja työkalujen terät.[2][3][4][5][7][6][8]
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b William M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics, s. 4–53. 39th Edition. CRC Press, 2012. ISBN 978-1439880494. Kirja Googlen teoshaussa (viitattu 19.11.2022). (englanniksi)
- ↑ a b c d e Jochen Greim & Karl A. Schwetz: Boron Carbide, Boron Nitride, and Metal Borides, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2006
- ↑ a b c d Robert H. Wentorf Jr.: Refractory Boron Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2000.
- ↑ a b c d Kenneth L. Roberts & Leroy Covington, Jr.: Nitrides, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2005.
- ↑ a b c d Peter Ettmayer & Walter Lengauer: Nitrides, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000.
- ↑ a b c d Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 146. Walter de Gruyter, 1994. ISBN 978-3110114515. (englanniksi)
- ↑ a b c E. M. Karamäki: Epäorgaaniset kemikaalit, s. 549. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3.
- ↑ a b c d Pradyot Patnaik: Handbook of inorganic chemicals, s. 129-130. McGraw-Hill Professional, 2002. ISBN 9780070494398. (englanniksi)