Ero sivun ”Vetyfluoridi” versioiden välillä
| [arvioimaton versio] | [arvioimaton versio] |
pEi muokkausyhteenvetoa |
pEi muokkausyhteenvetoa |
||
| Rivi 21: | Rivi 21: | ||
== Käyttö ja valmistus == |
== Käyttö ja valmistus == |
||
Vetyfluoridia käytetään muun muassa [[polymeeri|polymeerien]] fluorauksessa, maaöljyn jalostuksessa, lasinvalmistuksessa ja [[Etsaus_%28valmistustekniikka%29|etsauksessa]], alumiinin tuotannossa ja [[uraaniheksafluoridi]]n syntetisoinnissa. Vetyfluoridin vesiliuos myös syövyttää oksideja, joten sitä käytetään [[Teräs|teräksen]] valmistuksessa ja [[puolijohde]]teollisuudessa [[pii]]n epäpuhtauksien poistossa. |
Vetyfluoridia käytetään muun muassa [[polymeeri|polymeerien]] fluorauksessa, maaöljyn jalostuksessa, lasinvalmistuksessa ja [[Etsaus_%28valmistustekniikka%29|etsauksessa]], alumiinin tuotannossa ja [[uraaniheksafluoridi]]n syntetisoinnissa. Vetyfluoridin vesiliuos myös syövyttää [[Oksidi|oksideja]], joten sitä käytetään [[Teräs|teräksen]] valmistuksessa ja [[puolijohde]]teollisuudessa [[pii]]n epäpuhtauksien poistossa. |
||
Vetyfluoridia valmistetaan [[kalsiumfluoridi]]sta ja [[rikkihappo|rikkihaposta]]. |
Vetyfluoridia valmistetaan [[kalsiumfluoridi]]sta ja [[rikkihappo|rikkihaposta]]. |
||
Versio 2. helmikuuta 2008 kello 23.04
| Vetyfluoridi | |
|---|---|
[[Tiedosto: |275px|]] |275px|]] |
|
| Tunnisteet | |
| Muut nimet | Fluorivety, Fluorivetyhappo |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | HF |
| Moolimassa | 20,008 g/mol |
| Ulkomuoto | Väritön neste tai kaasu |
| Sulamispiste | -84 °C (189,15 K) |
| Kiehumispiste | 19.54 °C (292,69 K) |
| Tiheys | 0.922 kg/m3 |
| Liukoisuus veteen | Erittäin hyvä |
Vetyfluoridi eli fluorivety (HF) on vedyn ja fluorin muodostama molekyyliyhdiste. Muista halideista poiketen vetyfluoridin kiehumispiste on hyvin lähellä huoneen lämpötilaa. Vetyfluoridin vesiliuosta kutsutaan fluorivetyhapoksi, joka on vain miedosti hapan , mutta vahvasti korrosoiva. Ainetta käytetään laajasti petrokemianteollisuudessa ja on tärkeä yhdiste niin kutsuttujen superhappojen valmistuksessa.
Vetyfluoridin rakenne
Vetyfluoridikiteet koostuvat siksakmaisista molekyyliketjuista. Molekyylien sisäiset kovalenttiset sidokset ovat noin 0,95 pikometriä pitkiä. Molekyylit ovat kiinni toisissaan sähköisellä vetovoimalla, vetysidoksilla. (Merkitty kuvaan katkoviivoilla.)
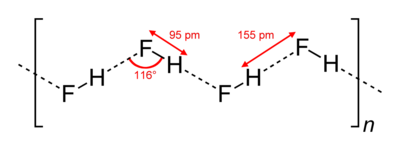
Myös nestemäisessä olomuodossa vetyfluoridimolekyylit muodostavat ketjuja, jotka tosin ovat lyhyempiä noin viiden tai kuuden molekyylin mittaisia. Vetyfluoridin korkeampi kiehumispiste muihin molekyylirakenteisiin halideihin verrattuna johtuu pitkälti vahvoista vetysidoksista.
Käyttö ja valmistus
Vetyfluoridia käytetään muun muassa polymeerien fluorauksessa, maaöljyn jalostuksessa, lasinvalmistuksessa ja etsauksessa, alumiinin tuotannossa ja uraaniheksafluoridin syntetisoinnissa. Vetyfluoridin vesiliuos myös syövyttää oksideja, joten sitä käytetään teräksen valmistuksessa ja puolijohdeteollisuudessa piin epäpuhtauksien poistossa.
Vetyfluoridia valmistetaan kalsiumfluoridista ja rikkihaposta.
- CaF2 + H2SO4 → CaSO4 + 2 HF
Ainetta myydään yleensä anhydridinä tai 70- tai 49-prosenttisina vesiliuoksina eli fluorivetyhappona. Voimakkaan reaktiivisuutensa ja syövyttävyytensä takia vetyfluoridia ja sen vesiliuosta säilytetään yleensä teflon-astioissa. Fluori ei reagoi teflonin kanssa joka itse on fluoriyhdiste.
Terveysvaikutukset
Aine on myrkyllistä ja voi olla jopa kuolettavaa pieninäkin annoksina ravinnossa tai ihon läpi imeytyneenä. Iholle joutuessaan aine voi aiheuttaa vakaviakin vaurioita ja hengitettynä tai nieltynä aiheuttaa pahoinvointia. [1]