Kaliumvetysulfaatti
| Kaliumvetysulfaatti | |
|---|---|
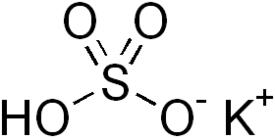 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | KHSO4 |
| Moolimassa | 136,178 g/mol |
| Ulkomuoto | Valkoista kiteistä ainetta[1] |
| Sulamispiste | 214 °C[1] |
| Tiheys | 2,32 g/cm3[1] |
| Liukoisuus veteen |
36,3 g/100ml (0 °C)[1] 49 g/100ml[2] (25 °C) 121,6 g/100ml (100 °C)[1] |
Kaliumvetysulfaatti eli kaliumbisulfaatti (KHSO4) on kalium- ja vetysulfaatti-ionien muodostama epäorgaaninen ioniyhdiste. Sitä käytetään muun muassa orgaanisessa synteesissä ja lisäaineena elintarvikkeissa.
Valmistus ja ominaisuudet
[muokkaa | muokkaa wikitekstiä]Kaliumvetysulfaattia tuotetaan kaliumsulfaatista ja rikkihaposta kuumentamalla ja kiteyttämällä.[1]
- K2SO4 + H2SO4 → 2 KHSO4
Kaliumvetysulfaattia muodostuu myös kaliumsulfaatin valmistuksen yhteydessä, kun kaliumkloridi ja rikkihappo reagoivat.[3]
- KCl + H2SO4 → KHSO4 + HCl
Kaliumvetysulfaatti liukenee hyvin veteen ja kuumaan paremmin kuin kylmään. Muodostuva vesiliuos on keskivahva happo johtuen vetysulfaatti-ionin protolysoitumisesta. Kaliumsulfaatti sulaa 214 °C:n lämpötilassa ja voimakkaammin lämmitettäessä se hajoaa kaliumpyrosulfaatiksi.[1][2]
Käyttö
[muokkaa | muokkaa wikitekstiä]Kaliumpyrosulfaattia käytetään elintarvikkeissa happamuudensäätöaineena. Yhdisteen E-koodi on E15, joka on sama myös kaliumsulfaatilla. Yhdistettä voidaan käyttää myös orgaanisessa kemiassa esimerkiksi anisolin valmistuksessa ja metallurgiassa niin kutsuttuna fluksina.[1]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h E. M. Karamäki: Epäorgaaniset kemikaalit, s. 309. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3
- ↑ a b Kaliumvetysulfaatin kansainvälinen kemikaalikortti
- ↑ Kaliumsulfaatin valmistus Keski-Pohjanmaan ammattikorkeakoulu. Arkistoitu 18.10.2015. Viitattu 6.1.2011.

