Hemi (kemia)
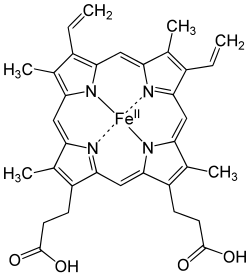

Hemi on kelaatteihin kuuluva prosteettinen ryhmä[1]. Ihmiselimistössä sitä on hemoproteiineissa. Hemoproteiineja ovat muun muassa hemoglobiini, myoglobiini ja elektroninsiirtoketjussa toimiva sytokromi c. Hemin keskusatomina toimii Fe2+-ioni, joka sitoutuu neljällä sidoksella polyfunktionaaliseen ligandiin, jona toimii protoporfyriini IX. Rauta(II)-ioni muodostaa lisäksi kaksi sidosta hemoproteiinin polypeptidiketjujen aminohappojen sivuketjujen kanssa. Happimolekyylin sitoutuessa hemiin rautaionin yksi sidos peptidiin katkeaa. Näin muodostuu sidos hapen ja rautaionin välille. Kaikki rautaionin muodostamat sidokset hemissä ovat koordinaatiosidoksia.
Happea sitovissa hemoproteiineissa eli myoglobiinissa ja hemoglobiinissa keskusatomina toimivan raudan hapetusluku on aina kaksi. Sen sijaan sytokromien normaaliin toimintaan kuuluu raudan hapetusluvun vaihtelu +II:n ja +III:n välillä. Syanidi-ionin myrkyllisyys perustuukin siihen, että se sitoutuu kolmiarvoiseen hemirautaan estäen näin sytokromia palautumasta pelkistyneeseen muotoon ja siten pysäyttää soluhengityksen.
Ihmisessä hemioksygenaasientsyymi hajottaa hemimolekyylin ensin biliverdiiniksi, joka edelleen hajoaa entsymaattisesti bilirubiiniksi.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Turunen, Seppo: Biologia: Ihminen, s. 178. 5.–7. painos. WSOY, 2007. ISBN 978-951-0-29701-8.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Human Metabolome Database: Heme (englanniksi)
- KEGG: Heme (englanniksi)