Ero sivun ”Hybridisaatio” versioiden välillä
| [arvioimaton versio] | [arvioimaton versio] |
p checkwiki fix |
|||
| Rivi 88: | Rivi 88: | ||
Tämä ei pidä paikkaansa tarkasti, mikäli yhdisteen keskusatomia kiertää myös ei-sitovia elektroneja ({{k-en|non-bonding electrons}}). Jos näitä on, sidoskulmat keskusatomin suhteen pienenevät. Ei-sitovilla elektroneilla ei ole toista atomiydintä kierrettäväkseen, jolloin ne "vievät enemmän tilaa" keskusatomin lähellä. Näin käy esimerkiksi ionilla PCl<sub>4</sub>+, jossa fosfori on sp<sup>3</sup>d hybridisoitunut. |
Tämä ei pidä paikkaansa tarkasti, mikäli yhdisteen keskusatomia kiertää myös ei-sitovia elektroneja ({{k-en|non-bonding electrons}}). Jos näitä on, sidoskulmat keskusatomin suhteen pienenevät. Ei-sitovilla elektroneilla ei ole toista atomiydintä kierrettäväkseen, jolloin ne "vievät enemmän tilaa" keskusatomin lähellä. Näin käy esimerkiksi ionilla PCl<sub>4</sub>+, jossa fosfori on sp<sup>3</sup>d hybridisoitunut. |
||
Hybridisaation käsitettä on käytetty selittämään myös metallien [[kompleksiyhdiste]]issä esiintyviä kovalenttisen |
Hybridisaation käsitettä on käytetty selittämään myös metallien [[kompleksiyhdiste]]issä esiintyviä kovalenttisen ''sidoksen'' ja keskusatomin välisiä sidoksia, mutta tässä tapauksessa molekyyliorbitaaliteoria on tieteellisesti eksaktimpi. |
||
[[Luokka:Kvanttikemia]] |
[[Luokka:Kvanttikemia]] |
||
Versio 1. marraskuuta 2008 kello 10.35
Atomiorbitaalien hybridisaatio on VSEPR- (engl. Valence Shell Electron Pair Repulsion) ja LCAO-teorioiden (engl. Linear Combination of Atomic Orbitals) selitys kovalenttisten ja polaaristen sidosten muodostumiselle eri atomien välillä. Hybridisaatiolla tarkoitetaan yleisesti atomiorbitaalien uudelleenjärjestymistä molekyyleissä, jolloin muodostuu uusia avaruudellisesti eri tavoin suuntautuneita molekyyliorbitaaleja.
sp3-hybridisaatio
Perustilassa olevan atomisen hiilen atomiorbitaalit ja niiden sisältämät elektronit voidaan kuvata seuraavasti (nuolien suunta kuvaa e-:ien spiniä):
Orbitaalit on siis täytetty Paulin kieltosäännön mukaisessa järjestyksessä. LCAO-teoriassa mitätöidään sivukvanttiluvun vaikutus orbitaaleihin seuraavasti: aluksi oletetaan orbitaalien, joilla on sama pääkvanttiluku, olevan samanarvoisia energian suhteen, ja sen jälkeen nämä yhdistetään vastaavaksi määräksi hybridiorbitaaleja, jotka nimetään erikseen.
jotka hybridisoítuvat
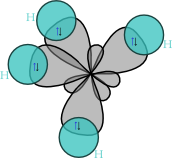
Hybridisoituneen atomin 2s2- ja 2p2-orbitaalit ovat järjestäytyneet uudelleen neljäksi samanlaiseksi sp3-hybridiorbitaaliksi. sp33-Hybridiorbitaalit muodostuvat yhden s-orbitaalin ja kolmen p-orbitaalin uudelleenjärjestyessä. sp3-Orbitaalit pyrkivät suuntautumaan mahdollisimman kauas toisistaan muodostaen tetraedrirakenteen, jossa sidosten väliset kulmat ovat 109,5°. Näin muodostetut hybridiorbitaalit selittävät esimerkiksi metaanin hiilen ja vetyjen välisten sidosten kokeellisesti havaitun samanlaisuuden:
Fysiikassa tämä teoria ei toimi, sillä muun muassa alkuaineiden spektrien ominaisuudet eivät selity hybridiorbitaalien kautta. Kemiassa käytettävät monet spektroskopian muodot on standardoitu siten että tutkimuksesta saatava vaste on helposti tulkittavissa todisteiksi hybridiorbitaaleja kuvailevan LCAO-teorian erinomaisesta sovellettavuudesta kemiallisessa analyysissä.
LCAO-teoriassa sama toteutetaan matemaattisesti tekemällä rajattuja yksinkertaistuksia ytimestä etäimmälle ulottuvia orbitaaleja kuvaaville yhtälöille.
C'*'-merkintä tarkoittaa edellä sitä, että hiiliatomit eivät ole kvanttimekaanisen atomimallin mukaisessa perustilassaan (joka kai toteutuisi absoluuttisessa nollapisteessä kaikille atomeille).
sp2-hybridisaatio
Kaksoissidoksen syntyessä yksi s-orbitaali ja kaksi p-orbitaalia hybridisoituu kolmeksi sp2-hybridiorbitaaliksi. Yksi p-orbitaali jää muuntumatta.
Esimerkiksi eteenissä (C2H4) on kaksoissidos hiiliatomien välillä. Eteenin rakennekaava on:
Kaksoissidoksen muodostuessa hiiliatomit sitoutuvat toisiinsa ensin hybridiorbitaalien muodostamalla sigma-sidoksella. Hiiliatomi muodostaa kaksi sigma-sidosta muiden atomien kanssa siten, että sidosten välinen kulma on 120° ja sidokset ovat samassa tasossa, joten kaksoissidoksen kohdalta molekyyli on tasomainen. Muuntumattomat 2p-elektronit ovat sigma-sidoksen tasoon nähden kohtisuorassa ja kahden vierekkäisen atomin muuntumattomat p-orbitaalit muodostavat sigma-sidoksen kanssa yhdensuuntaisen pii-sidoksen. Pii-sidoksen elektronitiheys on pienempi kuin sigma-sidoksen, jolloin se on sigma-sidosta heikompi ja reagoi helposti. Kaksoissidosta sanotaan tyydyttymättömäksi. Pii-sidos estää molekyylin kiertymisen akselinsa ympäri ja aiheuttaa sidokselle jäykän rakenteen.
Sp2-hybridisoituneita ovat kaksoissitouneet atomit, kuten olefiiniset hiilet (C=), joissa sp2-orbitaalit muodostavat sigma-sidokset ("yksöissidokset") ja kolmas p-orbitaali muodostaa pii-sidoksen ("kaksoissidoksen"), sekä karbokationit, joissa kolmas p-orbitaali on tyhjä, sekä karbanionit, joissa kolmannella p-orbitaalilla on "ylimääräinen" elektroni. Kolmen atomin renkaissa (esimerkiksi syklopropaani) hybridisaatio muistuttaa enemmän sp2:sta kuin aitoa sp3:sta.
Sp2-hybridisaatio on yksittäistä atomia kuvaava ideaalitilanne, jota todellisessa molekyylissä vastaavat monimutkaiset molekyyliorbitaalit, mutta sillä voidaan selittää "tavallisten" molekyylien muoto. Koska kolmannen p-orbitaalin muodostama pii-sidos on sigma-sidoksien alla ja päällä, se pitää särkeä, kun sidosta kierretään. Siksi kaksoissidokset eivät kierry normaaliolosuhteissa. Näkyvä tai ultraviolettivalo pystyy särkemään pii-sidoksen, jolloin nousevat korkeampaan energiatilaan, jossa pi-sidoksen elektronit ovat erillään eri atomien p-orbitaaleilla. Tällöin sp2-hybridisoitunutkin atomi voi pyöriä vapaasti. Jos sidos on ollut cis, se kääntyy vähemmän jännittyneeseen trans-konformaatioon, ja kun elektronit pariutuvat uudelleen, pi-sidos muodostuu uudelleen, jolloin sidos on muuttunut pysyvästi cis-sidoksesta trans-sidokseksi.
sp-hybridisaatio
Kolmoissidoksen kuvaamiseen tarvitaan sp-hybridiorbitaali. Kolmoissidosta muodostavalla atomilla on kaksi sp-hybridiorbitaalia. Kaksi p-orbitaaleista jää hybridisaation ulkopuolelle. Hiiliatomit liittyvät toisiinsa ensin yhdellä sp-orbitaalien muodostamalla sigma-sidoksella. p-Orbitaalien muodostamia pii-sidoksia syntyy kaksi. Sidosten välinen kulma on 180°, joten molekyyli on lineaarinen. Esimerkiksi etyynissä (C2H2) kolmoissidos muodostuu sp-orbitaalien välisestä sigma-sidoksesta ja p-orbitaalien muodostamasta kahdesta pii-sidoksesta.
Esimerkkejä
Hybridisaation käsitteellä pystytään ennustamaan monien molekyylien muotoja:
- AX2 (esimerkiksi, BeCl2): sp-hybridisaatio; lineaarinen
- AX3 (esimerkiksi, BCl3): sp²-hybridisaatio; kolmiomainen
- AX4 (esimerkiksi, CCl4): sp³-hybridisaatio; tetrahedraalinen
- AX5 (esimerkiksi, PCl5): sp³d-hybridisaatio; kolmiomainen bipyramidaalinen
- AX6 (esimerkiksi, SF6): sp³d²-hybridisaatio; oktahedraalinen (neliömäinen bipyramidaalinen)
Tämä ei pidä paikkaansa tarkasti, mikäli yhdisteen keskusatomia kiertää myös ei-sitovia elektroneja (engl. non-bonding electrons). Jos näitä on, sidoskulmat keskusatomin suhteen pienenevät. Ei-sitovilla elektroneilla ei ole toista atomiydintä kierrettäväkseen, jolloin ne "vievät enemmän tilaa" keskusatomin lähellä. Näin käy esimerkiksi ionilla PCl4+, jossa fosfori on sp3d hybridisoitunut.
Hybridisaation käsitettä on käytetty selittämään myös metallien kompleksiyhdisteissä esiintyviä kovalenttisen sidoksen ja keskusatomin välisiä sidoksia, mutta tässä tapauksessa molekyyliorbitaaliteoria on tieteellisesti eksaktimpi.