Kidekenttäteoria
Kidekenttäteoria on malli, joka kuvaa kiteisten yhdisteiden, ja erityisesti siirtymämetalliyhdisteiden ominaisuuksia perustuen niiden elektronirakenteeseen. Kidekenttäteoriaa voidaan soveltaa kiteisten aineiden värien muodostumiseen ja magneettisten ominaisuuksien selittämiseen. Mallia käytetään muun muassa ominaisuuksiltaan haluttujen yhdisteiden suunnitteluun. Kidekenttäteoriaa yhdistettynä molekyyliorbitaaliteoriaan kutsutaan ligandikenttäteoriaksi.[1][2][3]
Kidekenttäteorian periaatteet[muokkaa | muokkaa wikitekstiä]

Kidekenttäteoriassa atomien katsotaan olevan kovia, joustamattomia ja pallomaisia. Jokaisella atomilla on kiderakenteessa oma paikkansa, eli samassa paikassa ei voi olla kahta atomia. Ionien katsotaan olevan pallomaisia varauksia. Kaikkien vuorovaikutusten atomien välillä katsotaan olevan elektrostaattisia. Kidekenttäteoria tarkastelee erityisesti d-orbitaalien energioita. D-orbitaaleja on viisi, ja ne ovat dxy-, dxz-, dyz-, dz2- ja dx2-y2-orbitaalit. Näissä x, y ja z viittaavat karteesisen koordinaatiston akseleihin. Usein orbitaaleja pidetään energialtaan samanarvoisina eli degeneroituneina. Kidekenttäteorian mukaan näin ei kuitenkaan ole, vaan orbitaalit, jotka ovat sidosten suuntaisia, ovat energialtaan matalammalla kuin orbitaalit, jotka ovat sidosten välissä. Tätä kutsutaan energiatilojen jakautumiseksi eli splittautumiseksi. Energiatilojen splittautumiseen vaikuttavat seuraavat tekijät:[1][2][3][4][5]
- Mikä siirtymämetalliatomi on kyseessä
- Mikä on siirtymämetallin hapetusluku, koska eri hapetusluvuilla metalli-ionien elektronirakenteet ovat erilaisia ja ionit suosivat erilaisia koordinaatiolukuja.
- Ionin koordinaatioluku eli montako ligandia siihen on sitoutunut
- Ligandin laatu. Erilaiset ligandit suosivat erityyppisiä sitoutumisia ja tähän vaikuttaa muun muassa ligandin koko.
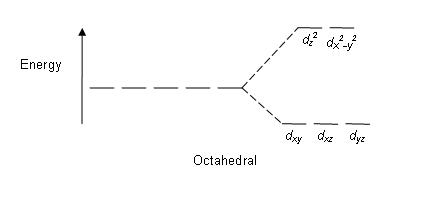
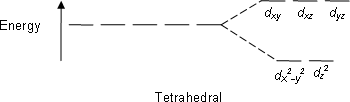
D-orbitaaleista orbitaaleilla dxy, dxz ja dyz on usein matalampi energia kuin orbitaaleilla dz2- ja dx2-y2. Kolmea ensimmäistä kutsutaan usein yhteisnimityksellä t2g-orbitaalit, ja kahta muuta kutsutaan nimityksellä eg-orbitaalit. Orbitaalien t2g ja eg välistä energiatilaeroa kutsutaan kidekentän jakautumisenergiaksi tai kidekentän stabilisaatioenergiaksi, ja oktaedrisen sitoutumisgeometrian tapauksessa siitä käytetään tunnusta Δo tai 10Dq.[1][2][3][4][5]


Elektronit voivat jakautua t2g- ja eg-orbitaaleille. Mikäli energiaero Δo on suuri, ovat elektronit ainoastaan t2g-orbitaaleilla ja yhdistettä kutsutaan matalan spinin yhdisteeksi. Jos energiaero on pieni, sijoittuvat elektronit myös eg-orbitaaleille ja tällöin on kyseessä korkean spinin yhdiste. Magneettiset ominaisuudet ja yhdisteen väri perustuvat spintyyppiin. Sijoittautumiseen vaikuttaa ligandien laatu ligandien spektrokemiallisen sarjan mukaan[1][2][3][4][5] . Spektrokemiallinen sarja on
Spektrokemiallisessa sarjassa vasemmalla olevat ligandit suosivat korkean spinin yhdisteiden muodostumista, kun taas oikealla olevat suosivat matalan spinin yhdisteiden muodostumista.[1][2][3][4][5]
Yhdisteen sitoutumisgeometria ja spinien jakautuminen[1][muokkaa | muokkaa wikitekstiä]
| Yhdisteen tyyppi | Muoto | Energiadiagrammi |
|---|---|---|
| Oktaedrinen |  |
 |
| Tasoneliö |  |
 |
| Tetraedrinen |  |
 |
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b c d e f g Geoff Rayner-Canham & Tina Overton: Descriptive Inorganic Chemistry, s. 511-520. 5th Edition. W. H. Freeman and Company, 2006. ISBN 978-1-4292-2434-5. (englanniksi)
- ↑ a b c d e f Steven S. Zumdahl, Susan A. Zumdahl: Chemistry, s. 977-982. 9. painos. Brooks Cole, 2008. ISBN 978-1-133-61109-7. (englanniksi)
- ↑ a b c d e f Thomas Scott, Mary Eagleson: Concise encyclopedia chemistry, s. 595-596. Walter de Gruyter, 1994. ISBN 978-3110114515. (englanniksi)
- ↑ a b c d e R. Gopalan: Concise Coordination Chemistry, s. 43-50. Vikas Publishing House, 2009. Kirja Googlen teoshaussa (viitattu 5.3.2021). (englanniksi)
- ↑ a b c d e CV. P. Tyagi: Concise Coordination Chemistry, s. 27-30. Ratna Sagar, 2009. ISBN 978-81-8332-571-4. Kirja Googlen teoshaussa (viitattu 5.3.2021). (englanniksi)