Ero sivun ”Aromaattinen yhdiste” versioiden välillä
| [katsottu versio] | [katsottu versio] |
pEi muokkausyhteenvetoa |
p "s. luku–luku" |
||
| Rivi 21: | Rivi 21: | ||
Hückelin sääntö ei välttämättä päde sellaisenaan polysyklisiin yhdisteisiin. |
Hückelin sääntö ei välttämättä päde sellaisenaan polysyklisiin yhdisteisiin. |
||
== Kaksi vaatimusta yhdisteen aromaattisuudelle <ref>{{Kirjaviite|Tekijä=Bruice, Paula Yurkanis|Nimeke=Organic Chemistry 7th edition|Vuosi=2014|Sivu= |
== Kaksi vaatimusta yhdisteen aromaattisuudelle <ref>{{Kirjaviite|Tekijä=Bruice, Paula Yurkanis|Nimeke=Organic Chemistry 7th edition|Vuosi=2014|Sivu=343–351|Julkaisija=Pearson Education}}</ref> == |
||
Jotta yhdiste olisi aromaattinen, sillä on oltava yhdisteen ylä- ja alapuolen kattava '''''1. yhtenäinen π-elektronipilvi''','' ja ''Hückelin säännön mukaan '''2.''' '''elektronipareja on oltava pariton määrä eli yksittäisiä elektroneja on oltava 4n+2 kappaletta''''', missä n on positiivinen kokonaisluku (elektronipareja on siis oltava 2''n'' + 1 kappaletta); |
Jotta yhdiste olisi aromaattinen, sillä on oltava yhdisteen ylä- ja alapuolen kattava '''''1. yhtenäinen π-elektronipilvi''','' ja ''Hückelin säännön mukaan '''2.''' '''elektronipareja on oltava pariton määrä eli yksittäisiä elektroneja on oltava 4n+2 kappaletta''''', missä n on positiivinen kokonaisluku (elektronipareja on siis oltava 2''n'' + 1 kappaletta); |
||
* Yhdisteen on oltava syklinen (rengasmainen), jotta ''π-elektronipilvi'' olisi yhtenäinen (1) |
* Yhdisteen on oltava syklinen (rengasmainen), jotta ''π-elektronipilvi'' olisi yhtenäinen (1) |
||
Versio 3. heinäkuuta 2020 kello 18.35
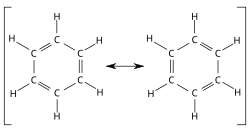
Aromaattiset yhdisteet ovat kemiallisia yhdisteitä, joissa on rengasrakenne, jonka elektronit ovat delokalisoituneet koko renkaan alueelle. Usein termiä käytetään synonyyminä bentseenirenkaan sisältäville yhdisteille, mutta muitakin aromaattisia yhdisteitä on olemassa.
Bentseenin lisäksi tyypillisiä yksirenkaisia aromaattisia yhdisteitä, tärkeitä synteesien lähtöaineita ja voimakkaita liuottimia, ovat tolueeni ja ksyleeni. Useamman aromaattisen renkaan sisältävät yhdisteet ovat kiinteitä. Esimerkiksi naftaleeni ja bifenyyli sisältävät kaksi rengasta.
Tavallisimpia esimerkkejä aromaattisista yhdisteistä, joissa ei ole bentseenirengasta, lienevät heteroaromaattinen pyridiini ja negatiivisesti varautunut syklopentadienyylianioni sekä luonnossa yleisesti esiintyvät porfyriinin johdannaiset, kuten hemoglobiinin rautaa kelatoiva osa.
Hückelin sääntö ja sidoksen luonne

Kaksoissidos koostuu sigma- ja pii-sidoksesta (σ ja π), ja kummassakin sidoksessa on kaksi elektronia. Delokalisaatio onnistuu vain, jos π-sidokset ovat samassa tasossa. Vain vierekkäisiin, mutta ei samaan hiileen liittyvä π-sidos on samassa tasossa. Tämä onnistuu esimerkiksi niin, että nimellisesti joka toinen sidos on kaksoissidos. Tarkemmin ottaen aromaattisuus selviää niin sanotulla Hückelin säännöllä:
- π-elektronien kappalemäärän pitää olla kaksi plus neljän monikerta (2 + 4n). Yksi kaksoissidos tuo kaksi elektronia.
Yksinkertaisin neutraali aromaattinen hiilivety on bentseeni, jolla on 2 + 4 eli 6 π-elektronia.
Hückelin sääntö kattaa myös poikkeukset sääntöön "joka toinen yksinkertainen, joka toinen kaksoissidos". Kahdeksanrengas syklo-oktatetraeenillä on 8 elektronia, mikä ei ole 2+4n, joten se ei ole aromaattinen vaan anti-aromaattinen, vaikka joka toinen on kaksoissidos. Toisaalta 2+4n-säännön täyttävä syklodekapentaeeni (10 π-elektronia) ei ole aromaattinen, koska sen kymmenen hiiliatomia käsittävän renkaan suosituin konformaatio ei ole tasomainen. Reaktiovälituote bentsyyni on aromaattinen, vaikka siinä on yksi kolmoissidos kaksinkertaisen sijaan. Syklopentadieeni ei ole aromaattinen yhdiste, mutta sitä vastaava anioni, syklopentadieenianioni, on aromaattinen, ja sen muodostuminen on entrooppisesti hyödyllistä, joten syklopentadieenilla on hiilivedyksi poikkeuksellinen voimakas happamuus. Syklopentadienyylianioni pystyy sitoutumaan pysyväksi metallikompleksiksi kaikille pii-elektroneillaan, esimerkiksi ferroseenissä.
Delokalisaation vuoksi aromaattinen rengas on entrooppisista syistä vakaampi kuin kaksois-, ja yksöissidosten ketju, joten aromaattien rengas on vakaa eikä reagoi helposti. Tämän voi ennustaa suoraan Schrödingerin yhtälöstä, jonka mukaan elektronin energia riippuu sen aaltofunktion kaarevuudesta: delokalisoituneen eli laajemmalla alueella liikkuvan elektronin aaltofunktio on vähemmän kaareva kuin lokalisoituneen elektronin. Entropia edistää myös asiaa: on todennäköisempää, että elektroni on koko renkaan matkalla delokalisoituneena kuin pelkästään kahden atomin välissä lokalisoituneena sidokseen.
Hückelin sääntö ei välttämättä päde sellaisenaan polysyklisiin yhdisteisiin.
Kaksi vaatimusta yhdisteen aromaattisuudelle [1]
Jotta yhdiste olisi aromaattinen, sillä on oltava yhdisteen ylä- ja alapuolen kattava 1. yhtenäinen π-elektronipilvi, ja Hückelin säännön mukaan 2. elektronipareja on oltava pariton määrä eli yksittäisiä elektroneja on oltava 4n+2 kappaletta, missä n on positiivinen kokonaisluku (elektronipareja on siis oltava 2n + 1 kappaletta);
- Yhdisteen on oltava syklinen (rengasmainen), jotta π-elektronipilvi olisi yhtenäinen (1)
- Yhdisteen on oltava planaarinen (tasomainen), jotta kukin p-orbitaali voi yhdistyä viereisten p-orbitaalien kanssa (ilman steeristä, sidoksen hajottavaa venytystä, sillä π-orbitaali on jäykkä) (1)
- Jokaisella renkaan atomilla on oltava p-orbitaali vapaana delokalisoituneille elektroneille (1)
- Elektronipareja on oltava pariton määrä (2)
Esimerkki aminohappo histidiinistä, jonka rengas on heterosyklinen (sisältää typpeä), mutta silti aromaattinen.

Lähteet
- ↑ Bruice, Paula Yurkanis: Organic Chemistry 7th edition, s. 343–351. Pearson Education, 2014.