Aminolevulinaattisyntaasi

Aminolevulinaattisyntaasi eli aminolevuliinihapposyntaasi on entsyymi, joka katalysoi aminolevuliinihapon muodostumista sukkinyylikoentsyymi-A:sta ja glysiinistä. Aminolevuliinihapon lisäksi reaktiossa muodostuu koentsyymi-A:ta ja hiilidioksidia.[1][2][3] Entsyymiä esiintyy eläimissä, sienissä ja alfaproteobakteereihin kuuluvissa bakteereissa. Entsyymi on osa porfyriinien biosynteesiä näissä eliöissä.[4] Aminolevulinaattisyntaasin EC-numero on 2.3.1.37[5].
Rakenne ja toimintamekanismi[muokkaa | muokkaa wikitekstiä]
Aminolevulinaattisyntaasi on rakenteeltaan kahdesta samanlaisesta alayksiköstä koostuva dimeeri[6] ja vaatii koentsyymikseen pyridoksaalifosfaatin. Nisäkkäissä entsyymistä esiintyy kahta eri isoentsyymiä, useissa kudoksissa esiintyvää ALAS1-isoentsyymiä ja vain punasoluissa esiintyvää ALAS2-isoentsyymiä. Näiden isoentsyymien aktiivisuuden säätely poikkeaa toisistaan.[5][1][3][4][7]
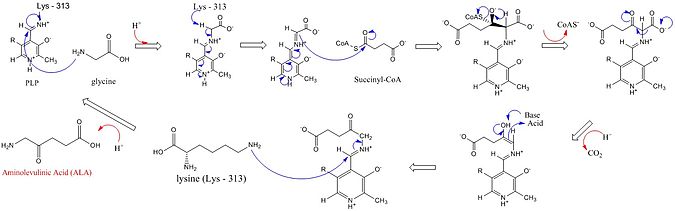
Aminolevulinaattisyntaasin katalysoiman reaktion mekanismin ensimmäisessä vaiheessa entsyymin aktiivisen keskuksen lysiiniaminohappo muodostaa imiinin eli Schiffin emäksen pyridoksaalifosfaatin kanssa. Tämä reagoi lysiinin kanssa muodostaen uuden imiinin pyridoksaalifosfaatin ja glysiinin kanssa. Tästä välivaiheesta irtoaa protoni ja muodostuva kinonoidivälivaihe reagoi sukkinyylikoentsyymi-A:n kanssa muodostaen epästabiilin 2-amino-3-ketoadipiinihapon, jonka dekarboksyloitumisen ja protoniensiirtojen jälkeen aminolevuliinihappo vapautuu entsyymistä.[6]
Aminolevulinaattisyntaasin inhibiittoreita ovat muun muassa hemoglobiini, hemi, hemiini sekä useat hemin esiasteisiin kuuluvat metalliporfyriinikompleksit.[5] Entsyymin vajaatoiminta aiheuttaa harvinaisen perinnöllisen sairauden erytropoieettisen protoporfyrian tai sideroblastisen anemian[2].
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b Jeremy M. Berg, John L. Tymoczko & Lubert Stryer: Biochemistry, 6th Edition, s. 702. W. H. Freeman and Company, 2006. ISBN 978-0-7167-8724-2. (englanniksi)
- ↑ a b Kaisa Timonen, Pauliina Nuutinen & Raili Kauppinen: Iho-oireiset hepaattiset porfyriat. Duodecim, 2012, 128. vsk, nro 121247-1255. Artikkelin verkkoversio. Viitattu 24.10.2023.
- ↑ a b Daniel L. Purich, R. Donald Allison: The Enzyme Reference, s. 74. Academic Press, 2003. ISBN 9780080550817. Kirja Googlen teoshaussa (viitattu 23.7.2015). (englanniksi)
- ↑ a b Lew Mander, Hing-Wen Liu: Comprehensive Natural Products II, s. 448–449. Academic Press, 2010. ISBN 9780080453811. Kirja Googlen teoshaussa (viitattu 23.7.2015). (englanniksi)
- ↑ a b c EC 2.3.1.37 - 5-aminolevulinate synthase Brenda. Viitattu 23.7.2015. (englanniksi)
- ↑ a b Junshun Zhang & Gloria C. Ferreira: Transient State Kinetic Investigation of 5-Aminolevulinate Synthase Reaction Mechanism. The Journal of Biological Chemistry, 2002, 277. vsk, s. 44660–44669. Artikkelin verkkoversio. Viitattu 23.7.2015. (englanniksi)
- ↑ John P. Greer,Maxwell Myer Wintrobe: Wintrobe's Clinical Hematology, s. 93–94. Lippincott Williams & Wilkins, 2008. ISBN 978-0781765077. Kirja Googlen teoshaussa (viitattu 23.7.2015). (englanniksi)