Absorptiospektri


Absorptiospektri on valon tai muun sähkömagneettisen säteilyn spektri, joka on muuten jatkuva, mutta jossa säteilyn absorption vuoksi tietyt aallonpituudet omaavaa säteilyä on tavallista vähemmän.
Absorptiospektrejä käytetään hyväksi kemiallisessa analyysissa tiettyjen aineiden esiintymisen toteamiseen ja usein niiden pitoisuuksienkin mittaamiseen. Niillä on käyttöä myös molekyyli- ja atomifysiikan tutkimuksessa. Spektrit voidaan havaita spektroskoopin avulla.
Absorptiospektri saadaan aikaan, jos tutkittavan näytteen lämpötila on alempi kuin sen takana olevan säteilylähteen, joka lähettää kaikkia taajuuksia sisältävää valkoista valoa.[1]
Säteilyn absorboituminen[muokkaa | muokkaa wikitekstiä]

Väliaineen absorptiospektri osoittaa, mikä osa sen läpi kulkeneesta säteilystä milläkin taajuudella tai aallonpituudella on absorboitunut. Spektri riippuu siitä, mitä atomeja ja molekyylejä väliaine sisältää.[2][3][4] Enimmäkseen absorboituu säteily, jonka taajuus vastaa atomin tai molekyylin kahden mahdollisen energiatason välistä kvanttimekaanista energiaerotusta.[1] Kutakin tällaista energiaeroa vastaa tietty spektriviiva, ja absorptiospektrissä on tyypillisesti useita tällaisia viivoja.
Taajuudet, joiden kohdalla on absorptioviiva, sekä niiden suhteelliset voimakkuudet, riippuvat pääasiassa atomin tai molekyylin rakenteesta ja elektronirakenteesta. Jonkin verran niihin vaikuttavat myös molekyylien väliset vuorovaikutukset, kiinteissä aineissa niiden kiderakenne sekä eräät ympäristötekijät kuten lämpötila, paine ja ulkoinen sähkökenttä.[1]
Absorptio- ja emissiospektri[muokkaa | muokkaa wikitekstiä]

Säteilyn emissio on ilmiö, jossa aine lähettää sähkömagneettista säteilyä. Atomi voi lähettää säteilyä samoilla taajuuksilla kuin vastaanottaakin sitä, ja sen vuoksi saman aineen absorptio- ja emissiospektrien spektriviivat vastaavat samoja taajuuksia.[1] Niiden voimakkuudet emissio- ja absorptiospektrissä voivat kuitenkin suuresti poiketa toisistaan.
Sovelluksia[muokkaa | muokkaa wikitekstiä]

Analyyttinen kemia[muokkaa | muokkaa wikitekstiä]
Absorptiospektrejä käytetään paljon hyväksi kemiallisessa analyysissä,[5] koska niiden avulla voidaan tarkoin tunnistaa aineet ja niiden määrät seoksessa. Esimerkiksi infrapunasäteilyn absorption avulla voidaan mitata ilmansaasteiden pitoisuudet ilmasta, sillä niiden absorptiospektrit eroavat selvästi typen, hapen ja vesihöyryn absorptiospektreistä.[6]
Absorptiospektrien avulla voidaan tunnistaa näytteet vertaamalla spektriä tunnettujen aineiden taulukoituihin spektriviivoihin. Monissa tapauksissa kemiallinen yhdiste voidaan tunnistaa, vaikka sen spektriä ei olisikaan taulukoitu. Infrapunasäteilyn alueella on olemassa tyypillisiä absorptioviivoja, jotka osoittavat aineessa olevan esimerkiksi hiilen ja vedyn taikka hiilen ja hapen välisiä sidoksia.
Absorptiota aiheuttavan aineen määrä voidaan mitata Beerin ja Lambertin lain avulla. Tällöin on tunnettava kunkin aineen absorptiokerroin, jotka on taulukoitu.
Kaukokartoitus[muokkaa | muokkaa wikitekstiä]
Yksi spektroskopian erityinen etu on, että sen avulla aineiden läsnäolo näytteessä voidaan tunnistaa ilman, että näytteen ja havaintolaitteen on oltava kosketuksissa toisiinsa. Säteily, joka on kulkenut näytteen läpi, kuljettaa mukanaan spektriviivoihin liittyvän informaation, mihin perustuu kaukokartoitus. Jos tutkittava aine on esimerkiksi myrkyllistä tai syövyttävää, mittaukset voidaan suorittaa välimatkan päästä ilman, että niistä aiheutuu vahinkoa mittauksen suorittajalle tai laitteille.
Kaukokartoituksessa on kuitenkin otettava huomioon, että myös tutkittavan näytteen ja laitteen välissä oleva aine, esimerkiksi ilma, absorboi säteilyä joillakin taajuuksilla. Nämä absorptioviivat saattavat olla vaikeasti erotettavissa tutkittavan näytteen aiheuttamista. Koska lisäksi kaukokartoituksessa käytettävän säteilyn lähde usein on auringon valo tai jonkin lämpimän kappaleen lämpösäteily, on myös pystyttävä erottamaan toisistaan absorptiospektri ja alkuperäisen säteilyn spektrin vaihtelut.
Tähtitiede[muokkaa | muokkaa wikitekstiä]
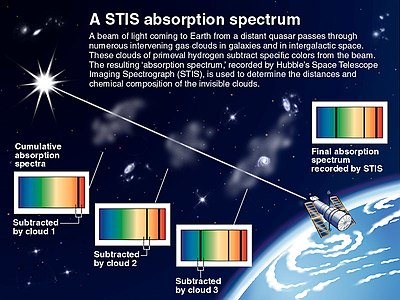
Absorptiospektreillä on erityisen suuri merkitys tähtitieteessä, jossa niitä käytetään taivaankappaleiden koostumuksen selvittämiseen. Tällöin kohteen suuren etäisyyden vuoksi niiden lähettämä sähkömagneettinen säteily onkin ainoa keino, jolla niiden koostumuksesta saadaan tietoa. Taivaankappaleiden säteily sisältää sekä absorptio- että emissiospektreihin perustuvaa informaatiota.
Absorptiospektrien avulla on tutkittu myös tähtienvälistä ainetta [7] ja eksoplaneettoja.
Atomi- ja molekyylifysiikka[muokkaa | muokkaa wikitekstiä]
Teoreettisten, varsinkin kvanttimekaanisten mallien perusteella atomien ja molekyylien absorptiospektrit voidaan liittää niiden muihin fysikaalisiin ominaisuuksiin kuten elektronirakenteeseen, atomi- tai molekyylimassaan ja molekyylin geometriseen rakenteeseen. Näin ollen nämä voidaan selvittää mittaamalla absorptiospektrejä. Esimerkiksi mikroaaltospektroskopian avulla voidaan atomien välisten sidosten pituudet ja niiden väliset kulmat mitata hyvin tarkasti.
Spektrimittauksien avulla on myös voitu selvittää, kuinka tarkkoja teoreettiset ennusteet ovat. Esimerkiksi vetyatomin absorptiospektrissä esiintyvää Lambin siirtymää ei sen havaitsemisen aikaan tunnettu teoria voinut selittää. Sen löytyminen johtikin kvanttielektrodynamiikan kehittämiseen, ja sen avulla voidaan varsin tarkasti mitata myös hienorakennevakio.
Aiheesta muualla[muokkaa | muokkaa wikitekstiä]
- Auringon absorptiospektri
- Näkyvän absorptiospektrin simulaatio (Arkistoitu – Internet Archive)
- HITRAN-tietokanta, joka sisältää tietoa monien molekyylien absorptiospektreistä (Arkistoitu – Internet Archive)
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b c d Karttunen, Hannu & Oja, Heikki & Kröger, Pekka & Poutanen, Markku: Tähtitieteen perusteet, Ursan julkaisuja 21, s. 129–130. Tähtitieteellinen yhdistys Ursa, Valtion painatuskeskus, 1984. ISBN 951-859-367-1.
- ↑ J. Michael Hollas: Modern Spectroscopy. {{{Julkaisija}}}. ISBN 978-0-470-84416-8.
- ↑ Harris, Daniel C. & Bertolucci, Michael D.: Symmetry and Spectroscopy: An Introduction to Vibrational and Electronic Spectroscopy. {{{Julkaisija}}}. ISBN 978-0-486-66144-5.
- ↑ Bernath, Peter F.: Spectra of Atoms and Molecules by Peter F. Bernath. {{{Julkaisija}}}. ISBN 978-0-19-517759.
- ↑ Ingle, James D. Jr. & Crouch, Stanley R.: Spectrochemical Analysis. Prentice Hall, 1988. ISBN 0-13-826876-2.
- ↑ Gaseous Pollutants – Fourier Transform Infrared Spectroscopy epa.gov. Viitattu 6.10.2011.
- ↑ Tähtitieteen perusteet, s. 136