Isomeria
Isomeria jaetaan rakenne- ja stereoisomeriaan. Isomeereja ovat molekyylit, joilla on sama molekyylikaava, mutta niiden rakenne on erilainen. Rakenteen erilaisuudesta johtuu myös isomeerien toisistaan poikkeavat kemialliset ja fysikaaliset ominaisuudet. Esimerkiksi butaanin ja isobutaanin kiehumispisteen ero on 11 astetta. Mahdollisten isomeerien määrä kasvaa nopeasti atomien määrän kasvaessa, esimerkiksi butanolilla (C4H9OH) on viisi erilaista isomeeriä.
Historia[muokkaa | muokkaa wikitekstiä]
Isomeria havaittiin ensimmäisen kerran vuonna 1828, kun Friedrich Wöhler kuumensi epäorgaanista ammoniumsyanaattia ja huomasi sen muuttuvan orgaaniseksi ureaksi, ja että näiden kahden aineen alkuainerakenne on samanlainen aineiden ominaisuuksien ollessa kuitenkin erilaiset.[1] Tämä löydös järisytti sen aikaista kemian tietämystä, jonka mukaan yhdisteillä on erilaiset ominaisuudet niiden erilaisten alkuainerakenteiden takia. Jälkeenpäin tehtyjen samankaltaisten havaintojen jälkeen otettiin käyttöön termi isomeria selittämään ilmiötä.
Rakenneisomeria[muokkaa | muokkaa wikitekstiä]
- Pääartikkeli: Rakenneisomeria
Rakenneisomeriassa atomien, sidosten ja funktionaalisten ryhmien paikat vaihtelevat. Tähän lajiin kuuluu ketjuisomeria, jossa pitkät hiiliketjut haarautuvat ja rakentuvat eri tavoilla. Paikkaisomeereilla funktionaalinen ryhmä voi sijaita eri paikoissa ketjua, kun taas funktioisomeereilla on sama molekyylikaava, mutta erilaiset funktionaaliset ryhmät.
Runkoisomeria[muokkaa | muokkaa wikitekstiä]
Runkoisomeriassa eli ketjuisomeriassa molekyylin hiiliketju voi olla haarautunut, haarautumaton tai rengasmainen. Haarautumatonta muotoa kutsutaan n-muodoksi ja haarautunutta iso-muodoksi. Runkoisomeriaa voi esiintyä lähes kaikilla hiilivedyillä.
Hyvin yleisessä käytössä oleva runkoisomeeri on moottoribensiinin sisältämä oktaani. Kun varsinainen oktaani on kahdeksan hiilen pituinen ketju, bensiinin iso-oktaanissa pisin yhtenäinen ketju on viiden hiilen mittainen ja kolme hiiliatomia on siirtynyt haaroiksi ketjun varrelle. Rakenteelliselta nimeltään aine on 2,2,4-trimetyylipentaani. Koska tyydyttyneissä hiilivedyissä ketjun päässä oleva hiiliatomi reagoi etusijalla, on tällä rakenteella saavutettu optimaaliset palamisominaisuudet, sillä tämän isomeerin ketjussa on viisi päätä.

Myös 2,2,3,3-tetrametyylibutaani olisi yksi mahdollinen oktaani-isomeeri, siinä olisi 6 ketjunpäätä, mutta se olisi liian epävakaa ja vaikeasti hallittava yhdiste.
Paikkaisomeria[muokkaa | muokkaa wikitekstiä]
Paikkaisomeria on seurausta funktionaalisesta ryhmästä, jonka paikka vaihtelee isomeereilla.
Esimerkiksi propanolilla on isomeereja: sen molekyylikaava on C3H7OH ja isomeerit
1-propanoli on primäärinen alkoholi, jossa hydroksyyli-ryhmä on sitoutunut hiiliketjun päätyyn ja 2-propanoli on sekundäärinen alkoholi, jossa hydroksyyli-ryhmä on sijoittunut hiiliketjun keskelle:

Funktioisomeria[muokkaa | muokkaa wikitekstiä]
Funktioisomeereilla on erilaiset funktionaaliset ryhmät. Esimerkiksi alla olevan propanolin funktionaalinen isomeeri on etyylimetyylieetteri, jonka molekyylikaava on CH3CH2OCH3 tai C2H5OCH3 .

Stereoisomeria[muokkaa | muokkaa wikitekstiä]
- Pääartikkeli: Stereoisomeria
Stereoisomeriassa atomien keskinäinen sitoutumisjärjestys on aina sama, mutta niiden avaruudellinen suuntautuminen on erilainen. Kun rakenneisomeereillä on yleensä erilaisia kemiallisia ominaisuuksia, käyttäytyvät stereoisomeerit useimmissa kemiallisissa reaktioissa samalla tavalla.
Konformaatioisomeria[muokkaa | muokkaa wikitekstiä]
Isomerialaji, joka johtuu yksinkertaisten sidosten kiertymisestä. Tämä isomerialaji eroaa muista isomerialajeista siten, että eri konformaatiomuodot voivat muuttua toisikseen ilman, että atomien välisiä sidoksia katkeaa. Esimerkkinä konformaatiosta on sykloheksaanin vene- ja tuolimuodot.
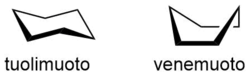
Geometrinen isomeria (Cis-trans-isomeria tai E,Z-isomeria)[muokkaa | muokkaa wikitekstiä]
Geometristä isomeriaa (cis-trans-isomeriaa) voi esiintyä vain sellaisilla yhdisteillä, jotka sisältävät kaksoissidoksia tai ovat sykloalkaaneja. Kaksoissidoksen π-sidos estää vapaan kiertymisen sidoksen ympäri. Tämän takia tällaisiin hiiliatomeihin liittyvät ryhmät joutuvat erilaiseen asemaan toisiinsa ja kaksoissidokseen nähden.
Fac-mer-isomeria[muokkaa | muokkaa wikitekstiä]
Fac-mer-isomeria on cis-trans-isomerian lisäksi toinen geometrisen isomerian tyyppi. Sitä esiintyy oktaedrisissa komplekseissa, joiden yleinen muoto on MA3B3. Fac-muodossa ligandit ovat molekyylin yhdellä puolella ja muodostavat oktaedrin yhden ulkopinnan (fac tulee sanasta facial eli kasvo-). Mer-muodossa ligandit muodostavat kaaren oktaedrin keskuksen ympärille (mer on lyhennys sanasta meridiaani).
-
fac-[CoCl3(NH3)3] -
mer-[CoCl3(NH3)3]
Optinen isomeria[muokkaa | muokkaa wikitekstiä]
Optista isomeriaa voi esiintyä vain yhdisteillä, jotka ovat kiraalisia eli niillä on ainakin yksi asymmetrinen hiiliatomi. Optiset isomeerit ovat toistensa peilikuvia. Niitä nimettäessä käytetään R/S-merkintää, joka juontaa sanoista rectus eli oikeakätinen, sekä sinister eli vasenkätinen. Tällaisia isomeerejä kutsutaan toistensa enantiomeereiksi. Optisten isomeerien liuokset kiertävät tasopolaroitua valoa vastakkaisiin suuntiin.
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ McMurry, John: Fundamentals of Organic Chemistry, s. 2. Lontoo: Thomson Learning, 2003. ISBN 0-534-39573-2.
Aiheesta muualla[muokkaa | muokkaa wikitekstiä]
- Opetus.tv: Kemian etäopiskeluympäristö, Konformaatioisomeria
- Opetus.tv: Kemian etäopiskeluympäristö, Cis-trans-isomeria
- Opetus.tv: Kemian etäopiskeluympäristö, Optinen isomeria
- Kandidaattikustannus: Orgaanisten yhdisteiden isomeria (Arkistoitu – Internet Archive) (pdf)

![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)

