Hopeakromaatti
| Hopeakromaatti | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
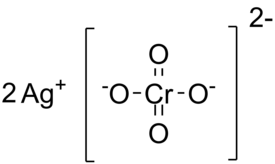
| Molekyylikaava | Ag2CrO4 |
| Moolimassa | 331,74 g/mol |
| Ulkomuoto | Punaruskea jauhe |
| Tiheys | 5,625 g/cm3 [1] |
| Liukoisuus veteen | 0,028 g/l (25 °C) [2] |
Hopeakromaatti (Ag2CrO4) on hopea- ja kromaatti-ionien muodostama ioniyhdiste. Ulkomuodoltaan hopeakromaatti on ruskehtavan punaista jauhemaista ainetta.
Ominaisuudet[muokkaa | muokkaa wikitekstiä]
Hopeakromaatti on huonosti veteen liukenevaa. Hopeakromaattia valmistetaan lisäämällä hopeanitraattiliuokseen jotain kromaattisuolaa, kuten kaliumkromaattia. Tällöin niukkaliukoinen hopeakromaatti saostuu.[2]
- 2 AgNO3(aq) + K2CrO4(aq) → Ag2CrO4(s) + 2 KNO3(aq)
Hopeakromaatti liukenee tiosulfaattiliuoksiin, koska hopeaionit muodostavat näiden yhdisteiden kanssa kompleksin.
- Ag+ + S2O32- → [Ag(S2O3)2]3- [4]
Laboratoriokäyttö[muokkaa | muokkaa wikitekstiä]
Hopeakromaatti ilmaisee muodostumisellaan Mohrin titrauksen loppupisteen. Mohrin titrauksessa tutkitaan näytteestä kloridi-ioneja. Tutkittavaan liuokseen lisätään indikaattoriksi kaliumkromaattia ja titrausliuoksena käytetään hopeanitraattia. Titrauksessa muodostuu aluksi hyvin niukkaliukoisen hopeakloridin saostuma, joka on väriltään valkoinen. Kaikkien kloridi-ionien saostuttua akaa saostua hopeakromaattia, jonka punaisen värin esiin tuleminen ilmaisee titrauksen loppupisteen.[5].
Muu käyttö[muokkaa | muokkaa wikitekstiä]
Hopeakromaattia käytetään maalaustaiteessa väriaineena. Hopeakromaattia käytetään tuottamaan punavioletteja ja okran sävyjä.[6].
Orgaanisen kemian synteesissä hopeakromaattia käytetään katalyyttinä muodostettaessa alkoholeista aldoleita.[2]
Hopeakromaattia käytetään litium-hopeakromaatti-paristoissa, joissa elektrolyyttiliuoksena käytetään litiumheksafluoriarsenaattia metyyliformiaattiliuoksena tai litiumperkloraatin propyleenikarbonaattiliuosta. Litium-hopeakromaattiparistossa litium hapettuu litiumkromaatiksi ja hopeaionit pelkistyvät. Reaktion tuottama lähdejännite on 2,7V ja kokonaisreaktio on:
- 2 Li + Ag2CrO4 → Li2CrO4 + 2 Ag [7]
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ Silver Chromate Crystran Ltd.. Viitattu 10.6.2009. (englanniksi)
- ↑ a b c Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds, s. 351. CRC Press, 1995. ISBN 9780849386718. Kirja Googlen teoshaussa (viitattu 10.6.2009). (englanniksi)
- ↑ Silver Chromate Safety Data Sheet. 24.7.2021. Sigma-Aldrich/Merck. Viitattu 21.1.2022. (englanniksi)
- ↑ Bassam Z. Shakhashiri: Chemical Demonstrations, s. 149. Univ of Wisconsin Press, 1989. ISBN 0-299-11950-5. Kirja Googlen teoshaussa (viitattu 10.6.2009). (englanniksi)
- ↑ James Swarbrick (Vesa Virtanen): Encyclopedia of Pharmaceutical Technology, s. 3752. Informa Health Care, 2007. ISBN 9780849393914. Kirja Googlen teoshaussa (viitattu 10.6.2009). (englanniksi)
- ↑ Nicholas Eastaugh, Tracey Chaplin, Ruth Siddall: The pigment compendium, s. 343. Butterworth-Heinemann, 2004. ISBN 978-0-7506-5749-5. Kirja Googlen teoshaussa (viitattu 10.6.2009). (englanniksi)
- ↑ Non-aqueous primary battery having a pure silver chromate cathode freepatentsonline.com. Viitattu 10.6.2009. (englanniksi)



