Claisen-toisiintuminen

Claisen-toisiintuminen on sigmatrooppisiin reaktioihin kuuluva kemiallinen reaktio. Claisen-toisiintumisessa allyylivinyylieetteri toisiintuu γ,δ-tyydyttymättömäksi karbonyyliyhdisteeksi tai allyyliaryylieetteri toisiintuu o-substituoiduksi vinyylifenoliksi. Reaktio on saanut nimensä löytäjänsä Rainer Ludwig Claisen mukaan. Claisen raportoi reaktion ensimmäisen kerran vuonna 1912. Reaktio on käyttökelpoinen tapa valmistaa uusia hiiliatomien välisiä sidoksia.[1][2][3][4] Luonnossa esiintyvä Claisen-toisiintuminen on korismaattimutaasientsyymin katalysoima korismiinihapon toisiintuminen prefeenihapoksi.[5]
Claisen-toisiintumisen mekanismi[muokkaa | muokkaa wikitekstiä]
Ensimmäiset raportoidut Claisen-toisiintumiset olivat allyylivinyylieettereiden toisiintuminen kuumennettaessa tyydyttymättömiksi karbonyyliyhdisteiksi. Myöhemmin Claisen huomasi, että myös aryylivinyylieetterit toisiintuvat samankaltaisesti kuumennettaessa. Claisen-toisiintuminen on [3,3]-sigmatrooppinen toisiintuminen, jossa muodostuu tyydyttymätön karbonyyliyhdiste. Mikäli happiatomin viereisiin hiiliatomeihin on sitoutunut muu substituentti kuin vetyatomi, on muodostuva kaksoissidos (E)-isomeeri.[1][2][3]
Aromaattisten aryyliallyylieetterien Claisen-toisiintumisten mekanismi on samanlainen, mutta viimeinen vaihe on karbonyyliyhdisteen tautomerisoituiminen fenoliksi. Claisen-toisiintumisella muodostuu o-substituoituja fenoleita. Mikäli kummissakin ortoasemissa on jo substituentti, tapahtuu Claisen-toisiintuminen kaksi kertaa peräkkäin ja allyyliryhmä päätyy p-asemaan fenoliryhmään nähden.[1][2][3]
Reaktion muunnelmat[muokkaa | muokkaa wikitekstiä]
Claisen toisiintumisesta on useita muunnelmia. Allyylisesta asetaattiesteristä muodostuu voimakkaan emäksen vaikutuksesta enolaatti, joka pystyy reagoimaan Claisen-toisiintumisella ja muodostuu γ,δ-tyydyttymätön karboksyylihappo. Tätä kutsutaan Ireland–Claisen-toisiintumiseksi ja se tapahtuu jo huoneenlämpötilassa eikä muista Claisen-toisiintumisista poiketen vaadi lämmitystä.[1][2][3][4]
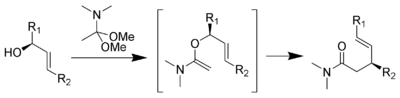
Johnson–Claisen-toisiintumisessa aldehydistä tai ketonista muodostettu asetaali tai ortoesteri reagoi allyylisen alkoholin kanssa muodostaen eetterituotteen, joka voi toisiintua tyydyttymättömäksi aldehydiksi, ketoniksi tai esteriksi.[1][2][3][4]
Eschenmoser–Claisen-toisiintumisessa ortoamidi eli amidiasetaali reagoi allyylisen alkoholin kanssa muodostaen γ,δ-tyydyttymättömän amidin.[1][2][3][4]
Lähteet[muokkaa | muokkaa wikitekstiä]
- ↑ a b c d e f Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 909–912. Oxford University Press, 2012. ISBN 978-0-19-927029-3. (englanniksi)
- ↑ a b c d e f Michael B. Smith & Jerry March: March's Advanced Organic Chemistry, s. 1668–1674. John Wiley & Sons, 2007. ISBN 978-0-471-72091-1. (englanniksi)
- ↑ a b c d e f Francis A. Carey & Richard J. Sundberg: Advanced Organic Chemistry B: Reactions and synthesis, s. 560–567. Springer, 2007. ISBN 978-0-387-68350-8. (englanniksi)
- ↑ a b c d Susan Budavari (päätoim.): Merck Index, s. ONR-17. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- ↑ Paul M. Dewick: Medicinal Natural Products: A Biosynthetic Approach. John Wiley and Sons, 2009. ISBN 978-0-470-74167-2. Kirja Googlen teoshaussa (viitattu 13.4.2015). (englanniksi)
Aiheesta muualla[muokkaa | muokkaa wikitekstiä]
 Kuvia tai muita tiedostoja aiheesta Claisen-toisiintuminen Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Claisen-toisiintuminen Wikimedia Commonsissa